|
近年来,随着一致性评价政策逐步明确、参比制剂不断公布以及新药注册法规鼓励创新药申报上市,化药注射剂市场受到不小的冲击,但同时也出现了很多新的市场机会。本文基于医药魔方数据库及医药魔方咨询分析,对中国化药注射剂市场的现状及机会进行梳理。
■注射剂市场概览
.png)
从市场规模来看,2019年中国化学药品市场规模6423亿元,其中注射剂占据主体地位,为57%。虽然整体市场发展成熟,但部分品种竞争仍不充分,竞争相对较小的化药注射剂品种(销售企业≤3家)占比达56%,销售额占比达18%,存在市场布局机会。
政策方面,注射剂一致性评价政策自2017年颁布以来,时间期限、审评审批标准、技术要求和参比制剂等政策逐步明确,但对于已上市产品的一致性评价仍未放开。因此,虽然近三年来注射剂一致性评价申报数量逐年增加,但截至2020年4月3日,只有29个品种通过一致性评价,且均为海内外共线或按新注册分类申报品种,尚没有已上市产品按标准流程通过一致性评价审批。
结合一致性评价的申报情况,至今尚无任何厂家通过一致性评价且正在申请厂家≤3家的注射剂品种的销售额占比超过80%,仍有较多后来居上的机会。
从参比制剂看,目前中国已公布参比制剂的注射剂品种有257个,仅占全部注射剂品种的20%,而且有80%的美国参比制剂还未纳入中国参比制剂目录。在已有参比制剂的注射剂中,还有33个品种目前尚无上市厂家,34个品种目前无已上市或DMF状态为A的原料药厂家。
此外,即使有些注射剂品种已公布参比制剂,但一致性评价进展也较缓慢。一致性评价厂家数≤3家的占近70%,其中7个品种的2019年销售额超过10亿且目前无厂家开展一致性评价,分别为前列地尔、醋酸亮丙瑞林微球、左卡尼汀、盐酸多柔比星脂质体、酒石酸布托啡诺、头孢噻肟钠和葡萄糖酸钙。
.png)
■注射剂布局机会分析
基于以上总结的注射剂市场竞争现状和一致性评价进展趋势,医药魔方认为,具有以下特点的注射剂仍有较大的机会。
.png)
1.2019年销售额超过5亿元的注射剂独家品种(以下仅为部分品种举例)
.png)
2.中国参比制剂目录中2019年销售额超过3亿元,且一致性评价厂家数≤3家的品种(以下仅为部分品种举例)
.png)
3.美国已上市,中国未上市,且2019年销售额超过2亿美元的品种(以下仅为部分品种举例)
综上,化药注射剂市场仍保持稳步增长的态势,且随着一致性评价等相关政策逐步完善,仍有很多机会等待企业发掘和进入。若企业能综合考虑市场情况进行合适的品种布局,将是一个弯道超车的好机会,可以建立起自己的优势地位,同时对国内医药事业的发展也有重大意义。
(信息来源:医药魔方)
新冠疫情的蔓延让全世界处于半停摆状态,而火热的生物医药领域短时间内似乎也无能为力,即便是被誉为人民希望的药物也没能扭转乾坤。但值得欣慰的是,依然有许多忧国忧民的企业在艰难时候挺身而出向疫情发起冲锋。本文统计了过去4个多月关于抗新冠药物研发的合作数据,非完全统计共计有139笔公开交易发生,由时间曲线可知在3.1-4.18为交易合作活跃期,恰好也是全球疫情大爆发曲线的前段。
.png)
交易数量随时间的关系
在这些交易中,资金主要来自于企业而非政府基金的合作占比55%(76项交易)。对于企业的商业逐利来说显然不太可能在此疫情下实现利益最大化,因为投资抗新冠药物研发产生的未来收益并不明朗。虽然新冠疫情的传染性很强,但致死率较低(病死率=5%),且疫情大规模蔓延相对于药物研发周期来说显然短得多,并且依靠现有条件多个国家已有效控制住了本国疫情。药物研发是理性的,并不会因为疫情的原因大幅缩短研发周期,经过必要的研发步骤后原本可观的市场大概率早已消失。
不论最终研发是否成功,目前参与研发有治疗效果药物的单位都值得被铭记和感恩。
众所周知药物研发投资是昂贵的,尤其在与时间赛跑的时候更体现稀缺性。据公开资料不完全统计,在统计中涉及的278家企事业单位中,强生与美国生物医学研发管理局宣布拟投入10亿美元用于抗新冠药物的研发,该合作金额拔得了公开研发合作金额第一的头筹;而宇宙第一大药厂Pfizer不甘示弱,斥资7.48亿美元引入BioNTech的疫苗项目;国际大药企纷纷发力,但最积极的选手当属美股生物技术公司Vir Biotechnology,它先后与葛兰素史克,三星生物,Biogen及药明生物等8家公司达成合作,平台型公司凸显科技实力。据Vir透露,他们拥有多个结合并中和冠状病毒(例如SARS和MERS)的全人单克隆抗体库。这些抗体是从感染SARS的幸存者体内分离出来的,其中一些单克隆抗体可能应对新型冠状病毒。
虽然参与者很多,但大部分合作依然处于早期研发阶段。在这139项合作中,可分为研发、许可、赞助、临床试验、生产等,其中约56%合作处于早期研发阶段,约9.3%的合作处于临床试验阶段,路漫漫其修远兮。
在所有的研发领域中,疫苗和抗体最受期待。在经历了疫情早期各种神药的蹭热点后,抗新冠病毒药物研发回归理性,拆解各个合作标的后得到目前的研发热度以疫苗(45%)为主,抗体(20%)和小分子(13%)次之。
据多家机构预测,疫苗或在未来12-18个月内问世。截至2020年4月8日,全球已有115个COVID-19候选疫苗在研发,其中可确认进展的有73个处于探索或临床前阶段,5个进度最快的候选疫苗已经进入临床阶段。中国目前已有多个COVID-19疫苗获批进入临床试验,其中陈薇院士团队的腺病毒载体疫苗获批进入临床研究,已于3月底完成了一期临床试验受试者的接种工作,并于4月9日开始招募二期临床试验志愿者,是全球首个启动二期临床研究的COVID-19疫苗品种。在相隔不久的4月12日,国家药监局批准了中国生物武汉生物制品研究所和中国科学院武汉病毒研究所联合申请的COVID-19病毒灭活疫苗进入临床试验;4月13日,国家药监局又批准了北京科兴中维生物技术有限公司研制的灭活疫苗开展临床试验。
抗体药物研发中,中和抗体的研发也被寄予厚望。Medrxiv预印本网站5月7日发布了来自于中国疾控中心主任、中科院院士高福团队COVID-19防控最新研究成果。团队分离出四种单克隆抗体,在体外实验中显示出病毒的中和能力,可以为COVID-19药物以及疫苗设计提供结构基础。而在此之前,济民可信,海正药业,上海君实,义翘神州,和铂医药,成都盛世君联等纷纷押注这个方向,已取得不错的进展。
虽然关于抗新冠病毒的研发合作如火如荼,但笔者却有深深的忧虑。毕竟获得资金资助的项目数量是有限的,在全球,依然有大量在没有外部资金支持情况下自筹资金向新冠病毒发起冲锋的“逆行者”们,而疫情终有结束的一天,这些“逆行者”们为了抗击疫情自发的付出以何种方式消化目前还没有权威人士提出解决方案。全部项目由社会全额买单不现实,而不理不睬这些可能毫无背景的“逆行者”更不行。虽然投身抗新冠疫情是自发行为,但他们的初心却是为了全社会的安全,如何处理他们因此产生的研发投入是值得深思的问题,毕竟疫情过去再好的产品也失去了市场。这个问题如果处理不好,可能会影响社会的价值观,笔者由此十分担心下次疫情到来的时候是否还有那么多“逆行者”为我们奋战。
(信息来源:药智网)Top
自2017年以来,中国的药品监管改革极大地改变了药品研发生态系统和生物制药行业状态。中国肿瘤学I期临床试验联盟(Chinese Phase 1 Oncology Trial Consortium)是致力于肿瘤学早期临床研究的合作组织,其在2017年年度报告中对中国肿瘤药物的早期(I期)临床开发情况进行了全面调查。2018年度的报告再次调查了中国肿瘤早期临床试验现状并与2017年进行了比较,希望对中国早期肿瘤药物临床试验的格局进行纵向分析,为肿瘤药物研发的未来策略提供一些启示。
2018年的调查报告围绕临床试验规模、肿瘤药物类型、癌种、研究机构数量等多个方面进行分析。
首先,在试验规模上,在经历了一年的改革之后,中国大陆的I期临床试验数量增加了102%,I期阶段的药物数量增加了85%(图1a)。2018年的364项I期研究共评估了312个药物,对患者志愿者的需求量相比2017年增加了两倍(7133 vs 20212)。首次人体试验(FIH)的占比也从9%(16/180)增加到15%(53/364)。就治疗策略而言,IO治疗已超过靶向治疗,成为中国肿瘤药物研发中最热门的策略。312个药物中有53%(165个)属于IO疗法,与2017年相比增长了416%,其作用机理也更加多样化(图1a)。
.png)
细胞疗法和双特异性抗体是增长最快的领域。2018年的I期阶段细胞疗法数量达到111个(2017年只有5个)。细胞疗法的类型从单一类别的CAR-T扩展到了六种类别,包括CAR-T、自体循环T细胞、NK细胞衍生疗法、TCR-T、工程T细胞和肿瘤浸润T细胞(图1b)。双特异性抗体(BsAb)是另一个新兴领域,2018年处于I期阶段的BsAb有13个,包括5个基于PD-1的药物,4个基于CD3的药物和4个针对HER2的药物。
从靶点上看,CD19和PD-1/PD-L1赛道略显拥挤。I期阶段的相关项目从2017年的28个增加到2018年的64个,并且CD19超过了PD-1成为最热门的靶标(图1c)。在37个CD19靶向疗法中,97%(36个)是CD19 CAR-T疗法。I期阶段的PD-1/PD-L1药物从2017年的27个增加到2018年的49个,其中44是单克隆抗体。
从肿瘤类型上看,2018年的肿瘤药I期试验涉及了更多类型的肿瘤,其中67.9%(247/364)招募了患有特定类型癌症的患者,试验数量最多的5个癌种依次是血液系统恶性肿瘤(85个)、肺癌(43个)、乳腺癌(19个)、胃癌(12个)和肝细胞癌(11个)(图1d)。特别值得注意的是,相比2017年,血液系统恶性肿瘤的试验数量增加了270%。另外,也有更多的I期试验是针对中国特色癌种(胃癌、肝细胞癌、食道癌和鼻咽癌,图1d),当前疗法无效的恶性肿瘤也开始引起更多关注(例如,胰腺癌)(图1d)。
.png)
与试验数量增长的趋势一致,参与肿瘤药I期研究的机构数量也显著增加,并显示出更加均衡的地理分布(图2a,b)。纳入统计的364项研究分布在中国22个省份的83个I期研究中心进行。尽管大多数I期临床试验仍集中北京、上海和广州,但这一比例已经从2017年的73%(131/180)下降至65%(236/364)。此外,I期临床试验的规模已从小型的“单中心”(single-site studies)研究逐步发展为”寡中心(oligo-site)”(2至4个中心,32项)或多中心研究(≥5个中心,8项)更加多见。每个试验所需的平均患者人数从40例增加到56例。
另一方面,研究者在早期临床研究的发起和开展中发挥了更大作用。2018年的364项肿瘤药I期临床试验中,国内生物制药公司资助的比例为71%(258项),跨国药企(MNCs)资助的比例下降至3%(10项),研究者发起的临床试验达到了26%(96项),2017年这个数字还只有5项,这说明在IO时代对研究者发起早期研究的态度更为宽松。不过这类研究的规模往往较小,设计更具探索性,平均入组人数是33例患者。研究者发起的96项研究中,47项(49%)将生物标志物评估纳入探索性目标,33项(34%)包含多个(≥3)扩展队列。
在免疫治疗时代,联合用药已成为趋势。2018年度的I期肿瘤药临床试验中,14.3%(52/364)为联合疗法试验,在17种恶性肿瘤中评估了34种联合用药策略。这些试验中有50%(26/52)包含至少一种IO药物,其中77%(20/26)是抗PD-1/PD-L1单克隆抗体。研究者还注意到,在这些联合试验中有25%(13/52)涉及两种以上新型药物,这个比例高于2017年的9%,也高于IO试验全球分析报告的3%(49/1105)。
总之,在药品监管改革以及中国医保和集采政策实施以来,中国药企开始越来越关注创新药研究。中国的I期肿瘤药临床试验在多个方面都有了显著增长。中国的肿瘤药研发也越来越关注临床需求未满足的中国特色癌种,FIH研究和探索性研究者发起的研究数量大大增加。但是,中国肿瘤新药早期开发的差距依然存在,包括缺少原创性新药,缺乏全球1期研究以及需要对新型-新颖组合试验进行更全面的监管。
(信息来源:医药魔方)Top
5月18日,《财富》杂志全球同步发布了2020年美国500强公司排名榜,这是该杂志对美国大公司的第66次排名。
今年上榜的500强企业占美国经济的三分之二,总收入达14.2万亿美元,较去年增长3.5%,总利润达1.2万亿美元,较去年涨幅为近8%,其中,医疗保健公司总收入领先其它行业,增长了12%。
共有23家医疗医药类企业进入本年度500强榜单,具体如下(单位:百万美元):
.png)
(信息来源:医药代表)Top
五月伊始,全国各地突发公共卫生事件响应级别陆续降级,这也意味着国内新冠疫情的缓和。一些慢性病患者在春节过后首次踏进了医院。
随着移动互联网的快速发展,基于慢病人群庞大的人口基数和慢病管理的高频行为特征,互联网慢病管理成为互联网医疗发展的热点之一。此次新冠疫情无疑是快速推动了互联网慢病管理的发展。
因为新冠疫情期间,大量公立医院、民营医院等实体医疗机构被用于新冠患者的救治与筛查,导致了不少病人有着日常诊疗和慢病复诊的需求无法满足。为避免这些患者交叉感染,互联网慢病服务的出现,及时解决了他们的燃眉之急。
经此一疫,慢病患者群体在疫情期间暴露的缺医断药问题也被社会各界关注,国家医保局、国家卫生健康委发布《关于推进新冠肺炎疫情防控期间开展“互联网+”医保服务的指导意见》,明确常见病、慢性病“互联网+”复诊服务可纳入医保基金支付范围。目前北京、上海、浙江省、天津市、四川省、武汉市等多个城市均已相继落地慢病纳入医保线上支付的举措,就此拉开了互联网慢病线上医保支付的序幕。
2019年中国疾病预防控制中心发布的调查数据显示,我国60岁及以上老年人群中,75.8%的人被至少一种慢性病困扰,且一人身患多种慢性病的现象普遍存在。
据国家卫健委最新统计数据显示,目前中国现有的慢性病患者已接近3亿人,每年增加1000万人,中国已经进入慢性病高发期,慢病患者群体规模为全球之最。2019年我国慢性病患病率已达23%,死亡数已占总死亡数的86%。预计到2020年中国慢病支出将提升至5.5万亿元左右。
为此,各大互联网医疗平台巨头纷纷加码慢病管理,如医联、平安好医生、阿里健康等,同时,资本市场也看好互联网慢病领域,近日,好心情也斩获了行业内最大单笔A轮融资,抢跑国内中枢神经领域医疗赛道。
■中国互联网慢病市场庞大,各大巨头纷纷入局
以前,线下慢病管理模式存在较多的问题,首先是患者到实体医疗机构找医生开处方拿药,虽然医生问诊的时间不多,但是对于患者来说,却需要花费较多的时间,包含到医院就医的时间、挂号时间、等候问诊和等候拿药的时间,最快也需要1天才能完成,于路途较远的患者来说,特别不便利。
其次是慢病患者的检验检测。如血糖的检测数据,无法连续测量和及时上传到医生手中,导致医生无法精确了解患者的血糖,进而做出适合每个患者科学又及时有效的慢病管理方案。
疫情的爆发,打破了原有的慢病管理模式,让大多数患者无法到实体医疗机构,慢病患者缺医少药的问题更为凸显。尤其是慢病患者在离开医院和医生后如何被管理的问题亟待解决。
.png)
现在,互联网与慢病管理的融合,线上与线下的相结合,不仅拓宽了慢病行业的发展空间,也实现了患者的多重诉求,即打破依从性、场景家庭化、决策精准性;满足患者长期持续用药、定期复查、定期监测体征数据以及经验分享和饮食调节等需求。
目前慢病管理市场参与主体众多,具体如下:
这些企业纷纷看好慢病市场,如平安好医生、京东健康、阿里健康、医联等互联网医疗巨头纷纷开启慢病管理市场争夺战。2019年10月,京东健康把慢病管理列为他们三大发展计划之一,驱动医疗向健康新时代迈进;2019年12月,平安好医生与默克签订战略合作协议。双方将携手探索在慢病管理等方面的数字医疗综合解决方案,推动中国智慧医疗健康发展,满足中国患者对高品质医疗健康服务的需求。
医联的互联网慢病管理则始于2018年,致力于打通医疗-医药-医保的就医闭环,推动互联网医疗行业的赛道细分的发展。这种慢病健康管理模式备受医生与患者的好评,它已成为了国内领先的慢病管理平台。
■疫情催化互联网慢病管理市场,医联提前布局
疫情期间,互联网医疗平台积极开拓咨询、义诊等栏目,为患者舒缓压力,包括医联、平安好医生、微医等多个互联网医疗平台陆续上线新冠肺炎义诊专区,用户量、问诊量成倍增长,其中医联平台注册医生数较疫情发生之前环比增长784%,注册患者数环比增长372%,平台问诊量环比增长159%。
功夫不负有心人,医联取得这些耀眼的成绩,全是提早抓住时机、选对方向的结果。医联从肝病领域切入,强医患关系链、成熟的药品供应链、以“患者”为中心,提升患者身体指标金标准。同时还在疫情期间早早地开通慢病管理系列服务,及时与上下游产业链进行合作,共同开启慢病管理研究等,目前已经服务到肿瘤、肾病、心血管、精神、呼吸等9大病种领域。
在医生端,医联于2014年拿到国内最早正规互联网医院牌照的企业,平台汇聚了全国超过80万实名认证医生和4.8万余名签约医生。
在技术上,医联希望帮助平台上的医生,让他们在有限的工作时间内尽量提高医生的接诊数量,服务更多的慢病患者。为此医联研发了AI辅助诊断、智能审方系统、智能随访库、结构化数据分析等智能手段为医生打造高效的慢病管理工具。这些让医生事半功倍的工具,极大促活了医联平台的医生活跃度,这为完成慢病管理闭环起到了决定性的作用。
在患者端,医联通过AI健康机器人、专属健康社群、智能穿戴设备、智能用药提醒等为患者提供全方位的慢病管理服务体系。
在选择慢病领域方面,医联最先的策略是避开了“高血压、糖尿病”等大多数企业首选的大患者群体。而是选择肝病相对比较冷门的领域。经过2年的印证,目前该平台上有6000余医生管理着约8万人次的肝病患者,全病程管理显著提升了诊疗效率,已然为肝病领域树立了患者管理的行业标杆。
站稳一个领域后,医联才开始慢慢拓展其他慢病领域。如HIV领域,它以践行艾滋病全程管理理念的互联网医院,提供艾滋病暴露前/后预防到治疗的全病程管理服务,内容涵盖关艾咨询、复诊购药、救助管理、心理关怀等。
在国家医保局积极引导并推动“互联网+”医保服务的政策背景下,成都医保局联合医联因地制宜地推出“互联网+”医保创新措施,在成都率先打通线上医保个账支付通道。患者在医联互联网医院平台上可以找到自己的专属就诊通道,不但可以用医保卡自行购买非处方药,慢性病患者还可以跟医生进行在线问诊,由医生为其开具电子处方,支付时可用医保卡里的个人账户进行支付,然后只需坐等药品送上家门。
■互联网慢病管理平台,将加速国内数字经济发展
来自2019年中国疾病预防控制中心发布的调查数据显示,我国60岁及以上老年人群中,75.8%的人被至少一种慢性病困扰,且一人身患多种慢性病的现象普遍存在。
乙肝、艾滋病、慢性肾病、部分肿瘤等疾病从原来的“不治之症”被重新定义为“可以调控、治疗、甚至治愈的慢性病”。人类进入了“带病生存”的时代,病情控制与管理的好坏决定了患者生活的质量甚至生存的尊严。如何做好慢病管理将成为未来医疗领域最重要的命题。
医联经过多年对互联网慢病管理平台的探索,已经找到了切实可行又高效的发展的策略,成为慢病领域的先驱者。随着我国人口老龄化的加剧和人们对于健康理念的日益重视,医疗需求持续攀升,尤其是慢病领域的患者需求,更值得期待。
在全球“百年未有之大变局”大背景下,数字经济发展的共识显得尤为可贵。2019年,以联合国为代表的全球性组织对数字经济予以极高关注,中国举办的以“数字经济”为题的大型会议也达到历史之最。2020年,虽然受疫情的影响,大多数的实体经济较为艰难,如餐饮、制造业;而以互联网为主的“数字经济”却发展较快,如美团、互联网医疗、线上教育、短视频;数字经济的快速崛起将成为未来经济的重要板块。
数字经济的崛起,将医疗行业从“互联网+”时代过渡到数字经济时代,互联网医疗成为医疗领域参与度最高的行业,正在被更多的用户接纳。疫情的催化,加速了用户的普及教育速度。更多的用户逐渐接受一些线上能解决的医疗服务,打破医院原本的物理局限,为更多患者提供优质的医疗服务选择,让医疗资源分配不均的问题得以解决。技术助推政策落地,实力推动了医疗改革真正的进步,百姓将会在此过程中不断提升其幸福感,享受到医改带来的实实在在的福利。
(信息来源:八点健闻)Top
5月21日,GSK与三星生物制药(Samsung Biologics)签订协议建立了合作伙伴关系,后者将帮助GSK扩大其创新生物制品的产能。
根据协议条款,三星生物将根据GSK的未来需求灵活提供生物制品大规模生产的额外产能,作为GSK现有生产网络的一个补充。GSK在未来8年将向三星生物支付不低于2.31亿美元,双方的合作将从红斑狼疮药物Benlysta (belimumab)的商业化生产率先开始,GSK从2020年开始向三星生物进行技术转移,预计2022年实现首次商业化供应。未来的合作范围还将扩大到其他专科药物。
GSK当前商业化销售的产品主要是集中在呼吸、感染病、神经/精神领域的小分子药物。除了疫苗之外,治疗用生物制品寥寥无几。Benlysta于2011年首次批准,是60年来首个新机制的红斑狼疮药物,该药的2019年全球销售额达到了7.85亿美元(+24.8%),该药于2019年7月也在中国获得了批准。另一款则是治疗哮喘的IL-5单抗Nucala(mepolizumab),该药的2019年销售额达到了9.83亿美元(+31.2%)。
相比默沙东、AbbVie等其他制药巨头而言,GSK此前对生物制品的依赖并不过分。不过生物制品的全球需求越来越大,GSK当前两个单抗产品也在快速增长,加上GSK重返肿瘤赛道的战略调整,通过收购Tesaro补充了肿瘤生物药管线,BCMA ADC药物和PD-1单抗dostarlimab均上市在即,这让GSK的生物制品产能面临瓶颈,因此选择三星生物这家韩国CDMO巨头也在情理之中。三星生物已经投资了26亿美元扩大产能,3个工厂的总产能达到36.2万升。2019年三星生物的收入为5.65亿美元。
GSK药品供应链总裁Regis Simard表示:“与三星生物达成的协议补充并加强了我们现有的世界一流的药品生产能力,将有助于确保我们能够继续为患者稳定提供所需要的创新型生物制品。”
(信息来源:医药魔方)Top
5月22日,科兴控股生物技术有限公司宣布,旗下子公司北京科兴中维生物技术有限公司获尚珹资本和维梧资本投资1500万美元,用于新型冠状病毒灭活疫苗克尔来福(CoronaVac)进一步的研制工作。两家投资者以可转债的形式各提供750万美元资金,到期后投资者可以选择将其转换为有息贷款或科兴中维总股本的各7.5%。
科兴中维的新型冠状病毒灭活疫苗研制工作进展顺利,在I期临床对疫苗的安全性进行初步观察后II期临床研究已于5月初启动。
5月6日,新冠疫苗临床前研究的结果在线发表于《科学》杂志,结果显示科兴中维的新型冠状病毒灭活疫苗在恒河猴模型中安全有效。这是全球首个新冠疫苗动物实验研究结果。该疫苗I期临床研究于4月16日开始,目的是评疫苗的安全性、耐受性和初步免疫原性II期临床研究要在更大范围的人群中评估疫苗的安全性和免疫原性,以确定疫苗的剂量和免疫程序。
目前,科兴中维正在北京大兴区建设新冠疫苗生产车间,预计投产后每年将供应1亿剂新冠疫苗。尹卫东表示,科兴中维正在和世界卫生组织和有关国家的监管机构、合作伙伴商讨III期临床研究的方案,希望在全球范围内尽快推动疫苗的后续研究和应用。
(信息来源:医药魔方)Top
江苏新元素医药科技有限公司近日完成约3000万美金的B轮融资,推进其痛风创新药ABP-671完成全球2期临床研究。本轮融资由丽珠医药和红杉资本中国基金领投,凯泰资本和达晨财智跟投完成。
新元素医药是一家以代谢性疾病和抗肿瘤创新药研发为核心的生物医药公司,其痛风创新药具有良好的疗效和显著的安全性优势,有望为全球痛风患者带来福音。公司也在治疗非酒精性脂肪肝炎(NASH)和抗肿瘤等领域有布局。此前,新元素医药已合计完成近亿元人民币融资,本次B轮融资资金将主要用于完成ABP-671在美国和亚洲的2期临床及后续临床试验,以及NASH药物的临床前与早期临床研究。
新元素医药创始人、董事长兼CEO史东方博士表示,在全球范围内,痛风领域药物在很长时间内鲜有突破。新元素医药1.1类抗痛风药物ABP-671已在美国完成1期临床的研究,正在开展2期临床研究。1期临床试验结果表明,ABP-671展现出良好的药效和安全性。在低剂量给药下,其药效相比现有市场同类痛风药物,具有明显的优势。将为痛风患者提供安全、高效以及长期用药的可能,具有全球竞争力。因此,公司对即将在2021年初获得的2期临床数据充满信心。史博士表示,我们很高兴得到多家顶尖的投资机构和知名药企的信任,这将助力我们把具有自主知识产权的创新药推向中国和全球临床试验,以期最终造福广大病患。
公司研发管线产品还包括治疗NASH和抗肿瘤等领域的创新药,其中的部分管线产品即将进入临床前或临床研究。治疗NASH的创新药与目前临床研究药物的作用机理不同,该类化合物具有很好的动物药效和安全性,对脂肪肝和肝纤维化起到全方位有效地预防和治疗作用。抗肿瘤创新药针对某些癌症具有极高的选择特异性,且表现出良好的抗肿瘤效果。
(信息来源:贝壳社)Top
梯瓦制药(Teva Pharma)近日宣布,中国国家药品监督管理局(NMPA)已批准Austedo(中文商品名:安泰坦®,通用名:deutetrabenazine,氘代丁苯那嗪片),用于成人患者治疗与亨廷顿病(HD)相关的舞蹈病以及迟发性运动障碍(TD)。该药上市申请此前被NMPA药品审评中心(CDE)纳入优先审评。值得一提的是,Austedo(安泰坦®)是全球首个获批的氘代药物,而中国是继美国之后全球第二个批准Austedo的国家。
作为快速审查程序的一部分,NMPA将Austedo纳入《临床急需境外新药名单(第一批)》名单,并给予优先审查,最终在4个月内完成审批程序,造福中国患者。这是继最近推出Treanda(存达®,通用名:bendamustine,苯达莫司汀)之后,梯瓦另一款特药(specialty medicine)在中国的第二次批准和预期上市。梯瓦将在中国独立实现这款药品的商业化。
Austedo(安泰坦®)的活性药物成分为deutetrabenazine(氘代丁苯那嗪),这是一种靶向囊泡单胺转运体2(VMAT2)的小分子口服抑制剂,VMAT2负责调节大脑中的多巴胺、5-羟色胺、肾上腺素、去甲肾上腺素等化学物质的水平。deutetrabenazine是已上市亨廷顿病治疗药物丁苯那嗪(tetrabenazine)的氘代药物。氘代以后,药代动力学特征得到改善,半衰期明显延长,从而可以使用更低的治疗剂量。
Austedo是全球批准的首个氘代药物。在美国,Austedo于2017年4月获得FDA批准,用于治疗与亨廷顿病相关的舞蹈病。2017年8月,FDA批准Austedo一个新的适应症,用于治疗成人迟发性运动障碍。
目前,有多家药企正在开发目前已上市药物的氘化药物。例如,Concert公司利用氘化学技术将JAK1/JAK2抑制剂ruxolitinib开发出了一款新产品CTP-543,在斑秃治疗方面取得了强劲疗效。ruxolitinib在美国已获批以品牌名Jakafi销售,用于治疗多种血液疾病。ruxolitinib的氘化学修饰可以改变其人体药代动力学,从而增强其作为斑秃治疗的用途。
(信息来源:生物谷)Top
赛诺菲(Sanofi)与再生元(Regeneron)近日联合宣布,美国食品和药物管理局(FDA)已批准Dupixent(dupilumab),用于治疗6-11岁中度至重度特应性皮炎(AD)儿童患者。该适应症通过优先审查程序获得批准,之前,FDA已授予Dupixent治疗采用外用处方药控制不佳的6个月-11岁儿童重度AD的突破性药物资格(BTD)。
值得一提的是,Dupixent是唯一被批准用于6-11岁中重度AD儿童群体的生物制剂,该药具体适应症为:作为一种附加维持疗法,用于采用外用处方疗法未能充分控制疾病或当这些疗法不可取的6-11岁儿童患者治疗中度至重度AD。
Dupixent是一种皮下注射制剂,在儿科(6-11岁)AD患者中有2种剂量方案,根据体重处方(在初始负荷剂量后,对于体重≥15公斤至<30公斤的儿童剂量为每4周一次300mg,对于体重≥30公斤至<60公斤的儿童剂量为每2周一次200mg)。
Dupixent是一种全人源化单克隆抗体,可抑制IL-4和IL-13的信号传导,该药不是一种免疫抑制剂。来自Dupixent临床试验的数据表明,IL-4/IL-13是2型炎症的关键驱动因素,在特应性皮炎、哮喘、慢性鼻-鼻窦炎伴鼻息肉病(CRSwNP)中起着关键作用。在全球已批准的这3个适应症中,超过15万患者接受了Dupixent治疗。
(信息来源:生物谷)Top
美国食品和药物管理局(FDA)近日批准Amivas公司青蒿琥酯静脉注射剂(artesunate for injection),用于治疗成人和儿童严重疟疾。该药通过优先审查程序获得批准,之前已被授予孤儿药资格。
值得一提的是,青蒿琥脂IV制剂是美国FDA唯一批准治疗严重疟疾的药物。需要注意的是,在采用静脉注射(IV)青蒿琥酯治疗严重疟疾时,后续应始终接受完整疗程的口服抗疟方案治疗。
在这项批准之前,青蒿琥脂IV制剂只能通过FDA的扩大准入计划提供给患者,这使得美国疾病控制和预防中心(CDC)能够向患有严重疟疾的美国患者和无法根据试验性新药(IND)方案口服药物的单纯性疟疾患者提供青蒿琥酯IV制剂。自2019年3月生产商停止销售奎尼丁(quinidine)以来,美国还没有FDA批准的治疗严重疟疾的药物。
(信息来源:生物谷)Top
Aurinia Pharma是一家致力于开发肾脏病和自身免疫性疾病创新疗法的生物制药公司。近日,该公司宣布,已完成向美国食品和药物管理局(FDA)滚动提交voclosporin治疗狼疮性肾炎(LN)的新药申请(NDA)。此前,FDA已授予voclosporin治疗LN的快速通道资格(FTD)。此次NDA提交包括了一项优先审查请求,如果准许,将使FDA对NDA的审查周期自提交之日起缩短至8个月,而标准的审查时限为12个月。
狼疮性肾炎(LN)是一种由自身免疫性疾病——系统性红斑狼疮(SLE)引起的严重肾脏炎症,代表着SLE的严重进展,如果不进行有效控制,可导致肾脏内永久性的、不可逆转的组织损伤,导致终末期肾病(ESRD),危及生命。目前,尚无FDA批准的LN治疗方法。
voclosporin有潜力成为FDA批准的第一个治疗狼疮性肾炎(LN)的药物。该药的NDA,基于一项广泛临床开发项目的支持,其中包括关键III期AURORA研究和关键II期AURALV研究。
voclosporin是一种研究性药物,这是一种新型、潜在同类最佳(best-in-class)的钙调神经磷酸酶抑制剂(CNI),拥有多个适应症方面超过2600例患者的临床数据。voclosporin是一种免疫抑制剂,具有协同和双重作用机制。voclosporin通过抑制钙调神经磷酸酶(CN),阻断IL-2的表达和T细胞介导的免疫反应,稳定肾脏足细胞(podocyte)。与传统的CNI相比,voclosporin具有更加可预测的药代动力学和药效学关系(可能不需要治疗药物监测)、效力增加(与环孢素a相比)和代谢谱改善。
在结构上,voclosporin是环孢菌素A(cyclosporine A)的一种类似物,具有一个额外的单链碳延伸,该单碳链上具有一个双键(烯键)。voclosporin与亲环素蛋白A(cyclophilin A)结合形成异二聚体复合物,再结合并抑制钙调磷酸酶发挥免疫抑制作用。voclosporin与环孢菌素A对人亲环素蛋白的结合亲和力相当,但voclosporin的烯键侧链在结合时可诱导钙调磷酸酶的结构变化,这可能导致与环孢菌素A相比具有增强的免疫抑制活性。
Aurinia公司预计,根据《哈奇-韦克斯曼法案》和其他国家的相应法律,在获得监管机构批准后,voclosporin在美国和某些其他主要市场(包括欧洲和日本)的专利保护将延长至至少2027年10月,儿科适应症的专利保护期预计将延长至2028年4月。此外,如果FDA将AURA和AURORA试验中使用的给药方案纳入产品标签中,该公司的一项涵盖voclosporin该给药方案的美国专利将使产品的保护期延长至2037年12月。
除了狼疮性肾炎(LN)之外,Aurinia公司也正在开发voclosporin滴眼液(VOS),用于治疗干眼症(DES)。目前,有3种FDA批准的治疗DES的处方药,其中2种是CNI。VOS有潜力通过减少实现DES症状和体征客观和主观缓解的时间,改进DES的治疗。
(信息来源:生物谷)Top
拜耳(Bayer)近日宣布已向日本厚生劳动省(MHLW)提交了一份关于其精准肿瘤学药物Vitrakvi(larotrectinib)的新药上市申请(NDA)。Vitrakvi是一种口服TRK抑制剂,专门用于治疗肿瘤中存在神经营养性酪氨酸受体激酶(NTRK)基因融合的晚期或转移性实体瘤儿童和成人患者。目前,Vitrakvi已在全球多个国家和地区获得批准,包括美国、巴西、加拿大、欧盟国家,在其他地区的申请正在进行或计划中。
拜耳制药部高级副总裁兼肿瘤学开发主管Scott Z.Fields医学博士表示:“通过这次提交,我们距离向日本患者和医生提供了一种专为成人和儿童TRK融合癌而设计的高度选择性疗法又近了一步,无论肿瘤类型或患者年龄如何,都有潜力显著改善治疗结果。先前,抗癌药物主要用于身体某一部位的癌症,而Vitrakvi是专为治疗TRK融合癌患者而开发的,无论肿瘤在体内何处起源。Vitrakvi是对抗这种罕见癌症的一个重要进展,因为它将取代那些并非专门针对这类癌症且没有在这类患者群体中证明有效性和安全性的昂贵治疗方法。”
Vitrakvi是一种首创的口服TRK抑制剂,其活性药物成分larotrectinib是一种强效、口服、选择性原肌球蛋白受体激酶(TRKs)抑制剂,旨在直接靶向TRK(包括TRKB、TRKB、和TRKC),关闭导致TRK融合肿瘤生长的信号通路。TRK融合驱动的肿瘤可以发生在身体的各个部位,常规治疗方案(如手术、化疗、放疗等)通常不能取得令人满意的治疗效果。
Vitrakvi是一种与组织学无关(histology-independent)的治疗方法,专门开发用于治疗携带NTRK基因融合的肿瘤,而不管肿瘤起源于身体的哪个部位。在TRK融合肿瘤儿童和成人患者中,Vitrakvi具有强劲疗效,包括针对原发性中枢神经系统(CNS)肿瘤和脑转移瘤,均可提供高缓解率和持久缓解,无论患者年龄及肿瘤组织学如何。
2018年11月底,Vitrakvi在美国获得全球首批,成为有史以来批准的第一个口服TRK抑制剂,同时也是第一个与肿瘤类型无关的“不限癌种、广谱”靶向抗癌药。目前,Vitrakvi已在全球多个国家和地区获得批准,包括欧盟。
(信息来源:生物谷)Top
5月26日,从清华大学获悉,该校药学院白净卫、李寅青与医学院生物医学工程系刘鹏课题组在北京市科委和清华自主研发计划支持下联合研发出一体化自助式SARS-CoV-2核酸检测卡盒(BINAS),卡盒具有居家检测的便捷性,30分钟内可获得检测结果。
该一体化自助式核酸检测卡盒需首先采集咽拭子或鼻咽拭子,送入一体化卡盒进行反应,最终可直接读取胶体金试纸结果。试剂卡盒采用两个推杆的设计,使用者将样本送入试剂盒后,将两个推杆上下各一推,30分钟即可查看结果。
清华大学药学院研究员白净卫表示,研究团队采取了巢式等温扩增(ITA)技术进行核酸检测。他介绍,核酸检测常用的检测方式,如荧光PCR法(Polymerase Chain Reaction,聚合酶链式反应),往往需要在严苛的实验环境条件和专业的设备下,经过2-3小时的繁琐操作和反应才能得到检测结果。此外,在取样过程中非常容易受到杂质的影响,从而导致核酸提取的损失,最终经常导致“假阴性”情况出现。
清华大学药学院研究员李寅青介绍,在设计过程中,研究团队通过优化裂解流程和后端扩增试剂,降低了检测过程复杂性,减少了因杂质导致的“假阴性”案例。李寅青称,使用新研发的技术对19例QPCR(传统的实时荧光定量PCR方法)阳性患者样本进行复核,结果显示该19例阳性患者的样本全部可以检出。
据悉,下一步,该项目团队将推进小批量卡盒装配,验证批量化生产的可行性,同时与医院合作,加快临床样本的验证。
(信息来源:新京报)Top
中国科学院上海药物研究所与海和生物联合研发的磷脂肌醇3-激酶(PI3K)α抑制剂CYH33已于近日获得美国食品药品监督管理局(FDA)的临床试验默示许可(IND),拟用于治疗晚期实体肿瘤。
PI3K信号通路失调涉及绝大多数人类癌症,PIK3CA(编码PI3K催化亚单位α)是人类肿瘤中常见的突变致癌基因之一,约2-5%的人类实体肿瘤中存在癌基因PIK3CA的突变,涉及肿瘤类型如乳腺癌、卵巢癌、结肠癌、成胶质细胞瘤、肺癌和食管癌等。
CYH33是上海药物所与海和生物共同研究开发的一种新型、高效、特异性的PI3Kα抑制剂,通过抑制PI3K介导的信号通路,阻滞细胞于G1期,从而抑制肿瘤细胞增殖。上海药物所杨春皓课题组利用自身发展的合成方法学,首次将药物化学优势结构吡咯并三嗪母核引入PI3K抑制剂的研究中,通过系统的构效关系研究,与丁健团队通力协作发现了候选药物CYH33。临床前研究表明,CYH33体内外活性优于同类已上市药物BYL719。
CYH33已开展的临床研究表明,化合物具有良好的安全性和初步临床疗效。目前国内未有选择性PI3Kα抑制剂获批上市。
(信息来源:上海药物研究所)Top
近日,argenx公司宣布,其开发靶向FcRn的“first-in-class”疗法efgartigimod,在治疗抗乙酰胆碱受体(AChR)抗体阳性全身性重症肌无力(gMG)患者的关键性3期临床试验ADAPT中,达到了主要研究终点。argenx公司计划在今年年底之前向美国FDA递交该疗法的生物制品许可申请(BLA)。
MG是一种罕见的慢性自身免疫性疾病。免疫球蛋白G(IgG)抗体会破坏神经和肌肉之间的沟通,引起虚弱和可能危及生命的肌无力。超过85%的MG患者在发病后18个月内进展为gMG,进而导致极度疲劳和面部表情、言语、吞咽和活动困难。确诊为AChR抗体阳性(AChR-Ab+)的患者约占gMG总患者数的80%-90%。
Efgartigimod是一款靶向FcRn的“first-in-class”疗法,旨在减少致病性IgG抗体,阻断IgG再循环过程。FcRn受体的作用是防止IgG的降解,因此通过防止IgG与FcRn的结合,能够导致介导自身免疫性疾病的IgG抗体更快耗竭,从而减轻疾病症状。
(信息来源:生物谷)Top
5月12日,国家医保局发布的《基本医疗保险用药管理暂行办法(征求意见稿)》截止征求意见。征求意见稿指出,国家医疗保障行政部门建立完善《基本医疗保险药品目录》动态调整机制,原则上每年调整1次。前不久,上海阳光医药采购网公示了20个议价价格高于五省市最低价的药品名单和10个《国家药品供应保障综合管理信息平台》无外省市价格信息的药品名单,并明确如果生产企业不能证明其价格合理性,将暂停挂网资格。
目前,北京、天津、山东、四川、湖南已公布了调出医保目录药品名单。河北、江西、安徽等省份也将按不同比例(40%、40%、20%)分3年调出,被调出医保目录的药品须由个人负担药费。
重点监控品种在医保报销、DRGs疾病分组及医院管理等因素制约下,院内销售可谓江河日下。加之国家和省级带量采购,把没有中标的产品挡在了公费报销的门外。再加上一直没有进入医保目录的产品。三者相加已是不小的比例。重点监控品种的最坏结局是调出医保目录。没有进入医保目录肯定是极大的不利因素,但不等于毫无希望。除非甘心退出市场,否则相关企业不但要有置死地而后生的决心,更要有实际方法和策略。
1、确认产品疗效
首先,冷静客观地分析产品。一种情况是国采、省采未中标的品种,要在标外市场寻求机会。
第二种情况是过去热销现在成了重点监控品种可能被调出医保目录,这些品种可能临床表现一般、没有医学支持,也可能有较好疗效,却被不正当营销所累,超剂量用药。前者已是明日黄花,没有再投入的价值,正常维持市场惯性即可;后者就要实事求是地进行学术推广,客观、公正地用于治疗病症,赢得医生和患者的信任,争取能留在医保目录内。即使被调出,也可凭“真才实学”生存。若时间许可,可更进一步对产品的安全性、有效性进行再研究,以确定疗效进入临床路径,为能再次进入医保目录奠定学术基础。
2、市场细分
一是拦截高端产品的跑方市场,如以DTP药房为重点。众所周知,DTP药房是处方外流的主要市场,既然不能进医院,不妨“农村包围城市”。在医院外广泛撒网,对同类药进行终端拦截。二是走低端而广阔的渠道。产品从高端医院撤出后,可到低端的第三终端和广阔院外市场发展,如诊所、药店、民营医院等,这些市场的销售量良好且一直保持稳定。
3、市场资源持续
若某个产品将来没有存在的价值,也不能一抛了之。虽然这个产品被淘汰,但由于推广这些产品的医院、医生和专家资源不会因此消失,企业要尽快找出替代这一药品的同类药,以期在原来的优势资源中寻求可持续发展。基于这种认识,如果企业没有现成的产品,应该立即着手开发同类新品,甚至为了抢时间,不惜购买产品以解一时之急。
4、发展线上市场
随着网销药品政策松动,线上市场将迎来大爆发。互联网具有广泛性和分散性,为此类药品提供了广阔的隐形市场。院内市场受阻,药企可以重新考虑布局线上销售。目前,国家政策已明确逐步放开线上市场,有准备的企业可以提前规划,借这波浪潮把产品推向全国,乃至全球。
5、放眼全球市场
每个国家的国情不同,某些药在国内受限,在国外可能受欢迎。对西方发达国家,可以创新药低价策略争取机会,甚至在海外建立产品开发中心;对发展中国家,可输出普药类品种。原料药有优势的企业可借原料药向制剂市场扩展,考虑在劳动力成本低廉的国家建立工厂,有可能“墙内开花墙外香”。
6、自费药走门诊处方
做好两手准备:一方面借医保目录动态调整的机会,做足工作争取让药品进入医保目录;另一方面做好进不了目录的准备。且不说院外市场,即使医院也不是一点机会都没有。仔细分析医院的用药结构会发现,所谓自费药在院内销售受限主要体现在住院用药,因为住院可享受医保统筹报销,大部分医院门诊不享受统筹报销。因此,门诊处方就有自费药的销售机会。自费药不受控费和国家集采限制,有腾挪的销售空间,从这一层面考虑,药品被调出医保目录并非全是坏事。
7、为转型争取时间
活在当下。毕竟还有3年的窗口期,要抓住这个短暂的机会,在没有被调出医保目录前尽全力做好市场和销售,能赚一年是一年。当然,前提是不能坐以待毙,“苟延残喘”是为转型赢得时间。如果以上招数用尽,还是没有希望,那就果断丢掉幻想换个思维,东方不亮西方亮,跳出这个领域可能就是一番新天地,如发展联合用药、中成药、保健用药、医疗器械,甚至跨界等。
总之,面对不利因素,企业不能墨守成规,要有新思维。从这方面讲,危机对中国医药企业也是一个机遇,就看你能否找得到?能否抓得住?
(信息来源:医药经济报)Top
5月14日,国家药监局正式宣布启动化药注射剂一致性评价工作,明确除氯化钠注射液、葡萄糖注射液、葡萄糖氯化钠注射液、注射用水、部分放射性药物等品种无需开展一致性评价之外,已上市的化学药品注射剂仿制药,未按照与原研药品质量和疗效一致原则审批的品种均需开展一致性评价。
国内很多大产品都是化药注射剂,涉及超过3500亿市场,所以一直以来才备受关注。本次化药注射剂一致性评价必将带来巨大变量。从目前进行的一致性评价工作和各省挂网情况来看,未来几年注射剂或许将迎来一批淘汰。本文整理了相关企业&品种TOP50分享给大家。
.png)
.png)
(信息来源:医药魔方)Top
受COVID-19疫情影响,今年ACSO也将进行网上会议。ASCO是全球最大的肿瘤临床研究年会,发布包括新机制药物、成熟机制药物的临床数据,以及临床检测或标记物的研究。近年来,国内企业越来越多地参加各项国际会议,不断增加全球新药研究领域的话语权。今天,我们从最新出炉的ASCO2020摘要中挑选部分国内在研新药的数据分享给大家。
■小分子篇
苏州泽璟
多纳非尼是苏州泽璟针对多激酶抑制剂索拉非尼开发的一种氘代药物,目前正在肝细胞癌、结直肠癌、甲状腺癌、鼻咽癌等适应症中开展临床研究,此次会议披露的是一项多纳非尼vs索拉非尼的一线肝癌数据。虽然目前在一线肝癌领域战胜索拉菲尼的药物寥寥无几,但索拉非尼中国化合物专利将于2020年到期,国内已有仿制药企业完成BE并申报上市,此举多少令多纳非尼的前景不是那么美好,该项研究的胜出,无疑增加多纳非尼的“钱途”,泽璟的股票率先做出了反应。
在这项开放标签、随机、II/III期临床试验(ZGDH3)中,从中国37个中心招募了无法切除或转移性HCC,患者随机分组(1:1)接受每天两次口服多纳非尼(0.2g)或索拉非尼(0.4g),直至无法耐受的毒性或疾病进展。结果显示多纳非尼的中位OS显著长于索拉非尼(12.1 vs 10.3个月,HR 0.831),中位无进展生存期(3.7m vs 3.6个月,p=0.2824)、客观缓解率(4.6% vs 2.7%,p=0.2448),疾病控制率(30.8%vs 28.7%,p=0.5532)较索拉非尼均略有提高但无显著差异。3级或更严重不良反应两者相当甚至多纳非尼较优,多纳非尼报告的严重AE患者人数有所减少(55[16.5%] vs 67[20.2%],p=0.2307),多纳非尼常见不良事件包括手足皮肤反应(50.5%)、天冬氨酸转氨酶增加(40.5%)、血液胆红素增加(39.0%)、血小板计数减少(37.8%)和腹泻(36.6%)。
江苏恒瑞
恒瑞本次会议披露了多项吡咯替尼、阿帕替尼的临床研究。
吡咯替尼是恒瑞医药开发的一种不可逆的泛ErbB抑制剂,本次会议披露吡咯替尼或拉帕替尼联用卡培他滨针对HER2+转移性乳腺癌(MBC)患者的临床3期研究。
在中期分析中,吡咯替尼+卡培他滨vs拉帕替尼+卡培他滨的中位PFS为12.5 个(95% CI 9.7–not reached)vs 6.8m(95%CI 5.4-8.1),满足统计显著性标准。在曲妥珠单抗耐药的患者中,还观察到吡咯替尼+卡培他滨的PFS延长(12.5 vs 6.9个月;HR 0.60,95%CI 0.29~1.21)。吡咯替尼+卡培他滨还显示了客观缓解率,缓解持续时间的获益(下表)。最常见的3级不良事件为腹泻(吡咯替尼与拉帕替尼组分别为30.6%和8.3%)、手足综合征(16.4%和15.2%)
除此之外,吡咯替尼还进行了分别针对HER2阳性、曲妥珠单抗耐药的转移性乳腺癌的数据分析研究,以及具有激活HER2突变NSCLC和其他晚期实体瘤临床研究。
阿帕替尼:中国患者占世界肝细胞癌(HCC)病例的50%以上,并且在病因、生物学行为、治疗策略和预后方面具有特殊特征。ASCO2020公布的这项随机、对照、双盲的III期研究在患有晚期HCC的中国患者中评估了阿帕替尼作为二线治疗的疗效和安全性。
在2014年4月1日至2017年5月03日之间,将393名患者随机分组并接受至少一剂研究治疗药物(阿帕替尼组261人,安慰剂组132人)。阿帕替尼的中位OS明显长于安慰剂(8.7m[95%CI 7.5-9.8] vs 6.8m[95%CI 5.7-9.1],HR 0.785 ([95%CI 0.617-0.998];p=0.0476)。与安慰剂组相比,阿帕替尼组的患者中位无进展生存期(PFS)也延长(4.5m[95%CI 3.9-4.7] vs 1.9m[95%CI 1.9-2.0];HR 0.471([95% CI 0.369-0.601];p˂0.0001)。阿帕替尼的客观缓解率为10.7%(95%CI 7.2-15.1),而安慰剂为1.5%(95%CI 0.2-5.4)。
与治疗相关的不良事件(TRAE)在阿帕替尼组中为250(97.3%)例,在安慰剂组中为92(70.8%)例。3级和4级最常见的TRAE是高血压(阿帕替尼组71例[27.6%],安慰剂组3例[2.3%])、手足综合征(46例[17.9%] vs 0)、血小板数减少(34 [13.2%] vs 1 [0.8%])和中性粒细胞减少(27 [10.5%] vs 0)。阿帕替尼组24例(9.3%),安慰剂组13例(10.0%)因不良事件而死亡,研究者均未发现与治疗相关。
此外,阿帕替尼还进行了一项前瞻性、开放、单臂、多中心的化疗后晚期软组织肉瘤(STS)患者疗效研究,总体而言,51例患者中有27例在六个月内无进展,6个月PFS率为53.32%(95%CI 37.76%,66.63%),至最终随访,ORR为18.75%(9/48)和 DCR为87.5%(42/48),中位PFS为7.13(95%CI 3.84,9.23)个月,中位OS在24.67(9.30-NE)个月时尚未达到。
SHR6390是细胞周期蛋白依赖性激酶4/6(CDK 4/6)的新型抑制剂。这项研究旨在评估SHR6390在晚期乳腺癌(ABC)患者中的耐受性、药代动力学、安全性和初步抗肿瘤活性。
在2016年4月15日至2018年12月21日之间共招募了40例患者。所有患者均被诊断出激素受体阳性和HER2阴性ABC,45.0%的患者至少接受过三种化疗,55.0%的患者至少接受过两种内分泌治疗。SHR6390的100mg,125mg和150mg队列分别扩大到10例,没有观察到剂量限制性毒性,并且未达到MTD。55.0%患者中观察到了3级的不良事件(AEs),即中性粒细胞减少症(52.5%)、白细胞减少症(35.0%)、血小板减少症(5.0%)和高血压(2.5%),没有严重的不良事件报道。疾病控制率为62.5%(25/40,95%CI 45.8%-77.3%),2名患者(5%,125mg一组,150mg一组)达到部分缓解,分别持续169天和356+天。
正大天晴
安罗替尼在本次会议至少披露了7项摘要,限于篇幅,我们仅节取2项。其他本次会议涉及瘤种分别为复发性晚期宫颈癌、复发性铂耐药或难治性卵巢癌、甲状腺髓样癌、复发或转移性原发性恶性骨肿瘤、晚期肉瘤。
安罗替尼联合埃克替尼一线治疗携带EGFR突变非小细胞肺癌(NSCLC)的研究招募了既往未接受治疗的携带EGFR外显子19缺失和/或外显子21 L858R突变局部晚期和/或转移性IIIB、IIIC或IV非鳞状NSCLC患者。2018年7月至2019年12月期间在五个中心招募了35例患者,给予安罗替尼(12mg,qd)和埃克替尼(125mg,tid),主要终点是PFS,次要终点是OS、ORR、DCR和安全性。数据截止2020年1月7日,对患者进行了中位6.01个月的随访。ORR为59%(0 CR,19 PR),DCR为88%(0 CR,19 PR,9 SD)。26例患者仍在接受治疗,最长的暴露时间是14个周期。15例外显子19缺失的患者中有10例(67%)应答,17例L858R突变的患者中有9例(53%)应答。18例患者在其他致癌驱动因素(PIK3CA或AKT1)和/或肿瘤抑制因子(TP53,RB1和PTEN)中存在畸变,ORR为72%。经分析,在97%(34/35)的患者中观察到AE,没有报告5级不良事件,最常见的3级不良事件是高血压(6[17%])、高甘油三酯血症(2[6%])、腹泻(1[3%])、高尿酸血症(1[3%])、手足皮肤反应(1[3%])、乏力(1[3%])和急性冠脉综合征(1[3%]),高甘油三酯血症是唯一的4级不良事件(2[6%])。
安罗替尼与依托泊苷联合顺铂/卡铂在未接受治疗的广泛期小细胞肺癌(SCLC)患者中进行了II期单臂试验。在2018年10月至2019年12月之间,纳入了27例患者,中位PFS为9.61个月(95%Cl:7.80-11.42),ORR为77.78%(21/27),疾病控制率为96.30%(26/27)。3级以上毒性包括中性粒细胞减少症22%、白细胞减少症11%、手足综合征15%、恶心4%、粘膜炎4%、水肿4%、厌食症4%、口腔干燥症4%和疲劳4%,无5级毒性。
TQ-B3525是一种新型的选择性口服PI3Kα/δ抑制剂,在临床前研究中,其抗PI3Kα和PI3Kδ的活性比Buparlisib高41倍和138倍。这项I期研究(NCT03510767)评估了TQ-B3525在中国晚期恶性肿瘤患者中的安全性,耐受性,药代动力学和抗肿瘤活性。
纳入已经历过至少两次先前的全身抗癌治疗的复发性或难治性(R/R)淋巴瘤患者,以及标准抗癌治疗失败的晚期实体瘤患者。TQ-B3525从每天一次的2mg、5mg、10mg、20mg口服给药到每天两次的10mg、20mg口服给药,在剂量递增阶段的第一个周期(28天)中观察到DLT。2018年6月至2019年12月,共招募40例患者,包括27例R/R淋巴瘤患者和13例晚期实体瘤患者。观察到三种DLT(均为3级高血糖症),所有级别的常见不良事件为高血糖(65.0%)、糖基化血红蛋白增加(35.0%)和腹泻(32.5%)。与治疗相关的3或4级AE发生在11例患者中(27.5%),最常见的也是高血糖症(10.0%)。ORR为60.9%(95%CI,38.5-80.2),≥10mg qd的ORR为70.0%(14/20,[95%CI,49.9-90.1])。对于R/R FL,ORR为72.7%(8/11,[95%CI,46.4-99.1])。在数据截止(2020年2月2日)时,未达到淋巴瘤的中位PFS。
TQ-B3139是新型ALK抑制剂,对广泛的ALK突变的活性比克唑替尼高3-7倍,这项I期研究(NCT03099330)旨在研究TQ-B3139在中国NSCLC患者中的安全性,并确定推荐的II期剂量(RP2D)和药代动力学(PK)、临床疗效。
纳入晚期NSCLC且至少一项全身性抗癌治疗失败的患者,采用3+3剂量递增设计,从50~100mg qd和200、300、400、500、600和800mg bid。总体ORR为73.0%(2 CR,44 PR);DCR为85.7%(8 SD)。200mg bid组的ORR和DCR分别为78.0%和89.8%,对于ALK TKI初治和耐药患者,ORR分别为78.7%(37/47)和56.3%(9/16)。对于具有可测量的基线脑转移的患者,脑病变的ORR为80.0%(8/10)。数据截止2020年1月23日,所有患者的PFS中位数为12.1个月(95%CI 8.5-15.6),200mg患者为12.2个月。初治患者未达到中位PFS(6个月PFS率为74.5%,95%CI 68.1-80.9),ALK TKI耐药患者为5.6个月(95%CI 1.6-9.5)。在具有高抗肿瘤活性的中国非小细胞肺癌患者中,TQ-B3139具有良好的耐受性,RP2D为600mg,TQ-B3139 vs Crizotinib在晚期ALK-TKI初治NSCLC患者中的随机III期试验正在进行中。
百济神州
ASCO2020大会上公布了泽布替尼 vs 伊布替尼治疗华氏巨球蛋白血症的III期ASPEN研究,入组患者201例。分别给予泽布替尼160mg,bid或伊布替尼420mg,qd。结果显示,泽布替尼在有效性和安全性上均优于泽布替尼:
CR+VGPR:28.4% vs 19.2%
12个月PFS(全部人群):89.7% vs 87.2%
12个月OS(全部人群):97.0% vs 93.9%
12个月PFS(复发难治人群):92.4% vs 85.9%
12个月PFS(复发难治人群):98.8% vs 92.5%
安全性:3级不良事件58.4% vs 63.3%,5级严重不良事件1.0% vs 4.1%
泽布替尼单药治疗华氏巨球蛋白血症的3年随访结果也在ASCO2020大会上公布。77例患者中包括初治24例,复发难治53例。结果显示:
VGPR/CE:初治33.3%,51.0%,45.2%
3年PFS生存率:初治91.5%,复发难治76.2%,总体80.5%
3年OS生存率:初治100%,复发难治80.2%,总体84.8%
安全性:3级以上不良事件初治45.8%,复发难治64.2%,总体58.4%
江西青峰
SC10914是PARP酶(包括PARP1和PARP2)的高度选择性抑制剂,具有与奥拉帕尼相似的结构,本次披露的I期研究,是评估SC10914在晚期实体瘤患者中的安全性、耐受性、PK/PD和初步疗效。
这是一项采用3+3设计的1期剂量递增研究,在中国的4个研究基地开展。患者在28天的周期内每天接受10种递增剂量的SC10914,剂量从30mg qd到500mg tid。截至2020年1月,共有52例患者入组,剂量升至500mg tid,未观察到DLT,也未获得MTD。与SC10914相关的3/4级AE和SAE发生率分别为34.6%(18/52)和13.5%(7/52)。共有17例可评估的gBRCAm卵巢癌患者入组,其中6例患有PR,ORR为35.3%(6/17)。将10例gBRCAm卵巢癌患者纳入tid组(包括2例开始接受BID剂量并在多个治疗周期后更改为300mg tid剂量的患者),其中5例具有PR,ORR为50%(5/10),400mg tid组的ORR为66.7%(4/6)。PK数据显示,在30mg至250mg剂量下,SC10914的暴露随剂量的增加而增加,SC10914的半衰期约为2-5小时。
亚盛医药
亚盛医药本次会议上也是披露了至少四项研究,涉及MDM2抑制剂APG-115药物2项(一项为国外患者研究)、Bcl-2/Bcl-xL抑制剂APG-1252和IAP拮抗剂APG-1387。限于篇幅,我们仅对其MDM2抑制剂APG-115国内研究进行描述。
APG-115是一种有效的小分子MDM2抑制剂和在多种肿瘤中具有抗肿瘤作用的免疫调节剂,尤其是那些具有MDM2扩增功能的野生型TP53(TP53wt+MDM2 amp)肿瘤,具有良好的抗肿瘤活性。
患有晚期脂肪肉瘤和其他实体瘤的患者在28天周期中的21天,每隔一天口服APG-115(100-200mg),主要终点是安全性和耐受性。截至2020年1月7日,以3种剂量的APG-115:100mg(n=11)、150毫克(n=8)和200毫克(n=2)治疗21例患者(14例脂肪肉瘤,2例滑膜肉瘤,2例腺样囊性癌,1例软骨肉瘤,1例骨肉瘤,1例横纹肌肉瘤),APG-115在200mg观察到两种DLT,分别为血小板减少症和发热性中性粒细胞减少症。最常见的治疗不良事件(TEAE)(≥20%)包括白细胞减少症、血小板减少症、中性粒细胞减少症、贫血等,5例患者(23.8%)发生可能与药物有关严重AE。在20例可评估疗效的患者中,部分缓解1例,疾病稳定12例,进行性疾病7例,疾病控制率(CR,PR,SD)为61.9%。在受益的13例患者(9例脂肪肉瘤)中,有11例具有TP53wt,7例具有TP53wt+MDM2 amp,包括1名具有PR的脂肪肉瘤患者(150mg),即使停止治疗,也可以维持10个月以上,表明APG-115的宿主免疫调节作用。
上海艾力斯
艾氟替尼为上海艾力斯医药科技有限公司研制的第三代EGFR抑制剂,用于治疗EGFR T790M突变NSCLC。
从2018年6月4日至2018年12月8日,招募了220例患者,中位年龄61.0岁,所有患者均携带EGFR T790M突变。到2019年4月12日,ORR为73.6%(95%CI 67.3-79.3),第6周和第12周估计的DCR分别为87.3%(95%CI 82.1-91.4)和82.3%(95%CI 76.6-87.1),中位PFS中7.6个月(95%CI 7.0-NA),尚未达到中值OS和DoR。209例(95.0%)患者发生至少一种不良事件(AE),大部分为1级或2级且耐受性良好。最常见的不良事件是天冬氨酸转氨酶升高(33[15.0%])、上呼吸道感染(33[15.0%])和咳嗽(33[15.0%])。42(19.1%)位患者发生了3至5级AE,最常见的是g-谷氨酰转移酶升高(n=4),3例患者死亡,其中2例可能与研究药物无关,1例无法确定。
限于篇幅,索凡替尼与安慰剂治疗晚期胰腺外神经内分泌肿瘤的健康相关的生活质量分析以及呋喹替尼联用信迪利单抗、沃利替尼、贝达vorolanib联用特瑞普利、Mek抑制剂HL085等其他研究,不再详述。
■抗体免疫治疗篇
百济神州
此次ASCO2020大会是百济神州首次公布替雷利珠一线治疗晚期鳞状非小细胞肺癌的III期数据,此外,TIM-3/PD-1的BGB-A425和引进的ZW25也是发布了最近动态,我们仅对替雷利珠的数据进行描述。
替雷利珠单抗联合化疗一线治疗晚期鳞状非小细胞肺癌(NSCLC)的III期BGB-A317-307研究是目前该疾病领域首个在全球获得成功的中国III期试验。BGB-A317-307研究共纳入了360例中国患者,研究显示,替雷利珠单抗联合化疗显著降低患者的疾病进展风险,延长了无进展生存时间(PFS),其中替雷利珠单抗+白紫+卡铂组mPFS达到了7.6个月,疾病进展风险显著降低52%(P<0.0001);替雷利珠单抗+紫杉醇+卡铂组的mPFS也达到7.6个月,疾病进展风险降低了48%(P=0.0001);而化疗对照组mPFS仅为5.5个月。75%的患者达到客观缓解,这一数据在对照组不到50%;替雷利珠单抗+白紫+卡铂组的客观缓解率(ORR)达到74.8%,替雷利珠单抗+紫杉醇+卡铂组的ORR达到72.5%,而化疗对照组的ORR仅为49.6%。患者的缓解持续时间(DoR)提升到单用化疗方案的2倍左右,其中替雷利珠单抗+白紫+卡铂组的mDOR达到8.6个月,替雷利珠单抗+紫杉醇+卡铂组的mDOR达到8.2个月,化疗对照组的mDoR仅为4.2个月。当前数据为中期分析研究结果,中位随访8.6个月,随着随访时间的延长,替雷利珠单抗治疗组的疗效数据有望进一步提升。
信达生物
信达生物此次携信迪利单抗、IBI318、IBI305等药物的多项研究登陆ASCO2020大会。
信迪利单抗是信达生物和礼来共同开发的PD-1抑制剂,本次重点披露的是一项用于晚期食管鳞癌二线治疗的随机对照II期临床研究(ORIENT-2),到达了预设的主要终点。
从2017年5月16日到2018年8月30日,将190例患者随机分组给予信迪利或化疗(n=95)。信迪利单抗组中位随访时间7.2个月,化疗组为6.2个月。信迪利单抗组的中位OS显著高于化疗(7.2 vs. 6.2个月,[HR] 0.70,P=0.034),ORR高于化疗组(12.6% vs 6.3%),中位缓解持续时间更长(8.3 vs 6.2个月)。全部级别的TRAEs发生率低于化疗(54.3% vs 90.8%),3-5级TRAEs发生率低于化疗(20.2% vs 39.1%)。肿瘤PD-L1肿瘤比例评分(TPS)≥1%和TPS≥10%的患者,信迪利单抗与化疗的ORR分别为20.2% vs 0%和35.7% vs 0%。在信迪利单抗组中,低NLR(<3)的患者的中位OS(HR 0.54,P=0.019)比高NLR的患者明显更长。
PD-1单抗+VEGF单抗的组合成为肝癌临床治疗的最大突破。此次ASCO2020大会上,信达也带来了信迪利单抗+IBI305(anti-VEGF)治疗晚期肝细胞癌Ib期研究初步结果。入组患者50例,其中29例是剂量递增研究,给予信迪利单抗200mg+IBI305 7.5mg/kg,另有21例进入了高剂量扩展研究,给予信迪利单抗200mg+IBI305 15mg/kg。截至2020/1/7,低剂量组ORR为24.1%,高剂量组ORR为33.3%。中位PFS尚未成熟。低剂量组6个月PFS生存率60.5%(95%CI 36.1, 78.0),高剂量组6个月PFS生存率75.8%(95% CI: 47.3, 90.2)。
君实生物
君实生物在5月7日宣布NMPA受理特瑞普利单抗用于治疗既往接受过治疗的局部进展或转移性尿路上皮癌(UC)患者的新适应症上市申请。
尿路上皮癌(UC)是全球范围内最常见的泌尿系统癌症。早期以手术治疗为主,对于不能手术的局部进展或转移性尿路上皮癌患者,以铂类为基础的化疗是其标准的一线治疗,随着化疗敏感性下降,会导致肿瘤复发和疾病进展。对于此类标准治疗后出现疾病进展的晚期尿路上皮癌患者,目前国内治疗手段非常有限。
此次在ASCO2020大会上公布的POLARIS-03研究(NCT03113266)是君实提交NDA的主要依据。该研究为一项开放性、单臂、多中心、II期关键注册临床研究,旨在评估特瑞普利单抗治疗标准治疗失败后的局部进展或转移性膀胱尿路上皮癌患者的安全性和有效性。至数据截止日,在符合评估条件的148例患者中,ORR为25.7%,PD-L1阳性患者(46例,31.1%)ORR达到41.3%,OS数据尚未成熟,安全性数据与特瑞普利单抗过往报道基本一致。
此外,在本届ASCO会议上,也公布了针对转移性黏膜黑素瘤总生存期和生物标志物分析,以及索拉非尼联合特瑞普利单抗治疗无法切除的肝细胞癌合并门静脉肿瘤血栓的探索性研究。
恒瑞医药
卡瑞利珠单抗于2019年5月获批上市用于治疗复发/难治性霍奇金淋巴瘤,2020年3月获批用于治疗晚期肝细胞癌。ASCO2020大会披露了涉及卡瑞利珠单抗联合苹果酸法米替尼用于晚期肾细胞癌和无法切除的尿路上皮癌的单组II期临床试验数据,在16例患者获得了确定的反应,所有患者均为部分反应,另外8例获得24周疾病稳定,RCC客观缓解率(ORR)为52.0%,UC客观缓解率(ORR)为30.0%,疾病控制率84.0%(RCC)和70.0%(UC),13/16确认的PR pts仍在接受治疗,未达到中位缓解持续时间。
在卡瑞利珠单抗联合阿帕替尼治疗宫颈癌的研究中,2019年1月21日至2019年8月1日之间,有45例患者登记并接受研究治疗,截至2020年1月22日,中位随访时间9.2个月(2.4-12.2),42例患者中有25例(59.5%)达到了客观缓解,包括2例(4.8%)完全缓解和23例(54.8%)部分缓解。未达到响应的中位数,疾病控制率为88.1%(37/42),中位PFS为7.6个月,PD-L1阳性患者较PD-L1阴性患者的PFS长(9.6 vs 5.3个月)。
康宁杰瑞
KN046是康宁杰瑞自主研发的全球首创重组人源化PD-L1/CTLA-4双特异性抗体,目前正在中国和美国开展II期临床试验,试验结果表明KN046与以前报道的其他单靶点免疫检查点抑制剂的安全性数据类似。ASCO2020大会公布了KN046在先前免疫检查点抑制剂治疗失败的晚期实体肿瘤患者中的临床数据,在符合评估条件的25例患者中,ORR为12.0%,疾病控制率52.0%,中位PFS为2.69个月,中位OS数据尚未达到。3个月和6个月的PFS率为41.0%和21.9%,6和9个月的OS率分别为88%和58.7%。
KN026是康宁杰瑞采用具有自主知识产权Fc异二聚体平台技术(CRIB)开发的抗HER2双特异性抗体,目前已在中美开展临床I期剂量递增及扩展研究,并在中国同步开展多项临床II期试验,包括联合化疗用于HER2阳性转移性乳腺癌一线治疗、单药用于标准治疗失败的HER2中低表达的转移性乳腺癌、单药用于HER2过表达或中低表达的晚期胃癌二线治疗等,以进一步探索KN026在不同的晚期实体瘤患者中的疗效和安全性。I期临床试验结果表明,KN026具有良好的耐受性和安全性。在多线抗HER2治疗后进展的HER2阳性63例转移性乳腺癌患者中,在推荐的第2阶段剂量水平下,客观缓解率为32.1%和疾病控制率为76.8%。
康方生物
AK104是康方生物自主研发的代首创PD-1/CTLA-4双特异性肿瘤免疫治疗药物,在美国癌症研究协会年会(AACR2020)上公布AK104联合化疗一线治疗晚期胃癌或胃食管结合部腺癌的Ib/II期研究初步结果,截止到2020年4月2日,共有19例可进行疗效评估的受试者,客观缓解率达到57.9%,疾病控制率达到94.7%,其中1例受试者达完全缓解,10例受试者达部分缓解,7例受试者疾病稳定;部分病人最长用药时间已超过42周,13例病人仍然在持续治疗。AK104联合mXELOX显示了良好的安全性,在21例受试者中,与免疫相关的3级不良事件仅有2例(9.5%),1例受试者出现因药物相关的不良事件导致停药。暂未观察到抗PD-1和抗CTLA-4联合治疗中常见的结肠炎。
AK105是康方生物自主研发的重组人源化抗PD-1单克隆抗体。AK105在中国正式启动2项注册性III期临床研究,也已经获得美国临床试验资格。在AACR2020上公布了AK105联用安罗替尼作为晚期肝细胞癌(HCC)的一线治疗的临床活性和安全性。在25个可评估患者中证实的ORR为24%(6/25),DCR为84%(21/25)。
在火热的免疫治疗领域中,从来都不缺乏中国药企的参与,本次会议上其他国内多家新进PD-1赛道玩家也公布了自己的数据,其中包括正大天晴(TQB2450,联用安罗替尼,确认的PR为5.88%,未确认PR23.5%,SD 52.94%)、Gls-010(复发性或难治性经典霍奇金淋巴瘤,ORR:91.76%;CR:35.3%,PR:56.5;转移性宫颈癌,ORR:28%)、HX008(ORR:28.3%,SD:41.5%,PFS:5.4m)等。
■ADC篇
荣昌生物
RC48-ADC是一种新型的抗HER2的人源化抗体偶联药物(ADC),RC48的中国II期临床试验结果曾在2019年第55届美国临床肿瘤学会年会(ASCO年会)公布,数据显示其疾病总体控制率达到90%,客观缓解率高达51%。这一试验结果填补国内外空白,在全球尿路上皮癌治疗领域具有里程碑意义,也吸引了广泛关注。
在ASCO2020会议上,RC48又带来了HER2过表达局部晚期或转移性胃或胃食管连接癌患者的有效性和安全性II期数据。截至2019年12月17日,已有127例患者入组,中位年龄58岁,有59名患者(46.5%)在接受治疗前接受了≥3线的治疗。研究者评估的ORR为18.1%,在接受2线和3线及以上患者中ORR为19.4% 和16.9%,mPFS为3.8个月,mOS为7.6个月。安全性与先前报告的RC48-ADC数据一致。
科伦药业
HER2是乳腺癌和胃癌的有效治疗靶标。A166是一种抗体-药物偶联物,由新型细胞毒性药物通过稳定的蛋白酶可裂解的缬氨酸瓜氨酸接头位点特异性地与transtuzumab偶联。本次披露的数据为A166的首次人体研究,针对对已批准的疗法无反应或停止反应的HER2阳性或HER2扩增局部晚期/转移性实体瘤患者。
截至2019年11月1日,共有35例患者完成了4种剂量水平的DLT评估期。总体而言,A166具有可接受的毒性特征,在任何研究的剂量水平上,均未记录到不良反应符合剂量限制毒性的规定。在可评估疗效的27例患者中,病情稳定9例(33%)和部分反应7例(26%),总疾病控制率59%。
另外也有ADC药物如SKB3264、MRG002/3等,但尚无相关临床有效性数据。
(信息来源:医药魔方)Top
目前,我国医药流通业主要是指药品从出厂到医疗机构与零售药店之间的一系列产品流通环节。就现在医院而言,我国公立医疗机构的药品流通环节实行两票制。
有数据显示,2018年我国公立医院、基层医疗机构、零售药店三大终端的药品销售额为17131亿元,同比增长6.3%(1)。其中公立医院终端占比为67.4%,零售药店终端占比为22.9%,公立基层医疗终端占比为9.7%。近几年,随着两票制的执行,调拨业务从40%降低到30%,直销终端的业务占比相应上升。流通企业大部分是国企,占比为61%,其次股份制企业占比为32%。
截至2018年末,全国共有药品批发企业13598家,其中全国性的药品配送企业有4家,分别是国药控股、上海医药、华润医药、九州通,其余均是地方性的配送商。我国各省的配送商格局差别较大,集中度高的地区如上海,预计药品配送集中数可达到80%,现大部分地区的为50%左右,其余多家小配送商瓜分剩余市场。
药品流通集中度提高,政策影响边际效应减弱。截至2018年,全国共有药品批发企业13598家。2012年高峰时期,药品流通企业数量达到1.63万家,后由于行业增速下降、兼并收购等原因回落。2015年开始实施的两票制进一步促进了行业整合,企业数量下降到1.30万家,此后小幅反弹。2011年-2018年的从34%增加到43%,集中度持续提高。药品流通行业受到两票制、零加成、药品降价、带量采购等政策影响。新药加速上市带来的增量与仿制药业务配送费用降低相互抗衡,政策对药品流通企业的影响边际效应逐渐减弱。其中,医药流通业(不包括药店)板块估值为15.3倍,相对于生物医药行业估值溢价率为-56%,是2011年以来的最低点。
一、我国药品终端销售额在2万亿元左右
2018年我国公立医院、基层医疗机构、零售药店三大终端的药品销售额为17131亿元,同比增长6.3%。
从实现药品销售的三大终端的销售额分布来看,公立医院终端市场份额最大,2018年占比为67.4%,零售药店终端市场份额2018年占比为22.9%,公立基层医疗终端市场份额近年有所上升,2018年占比为9.7%。
如果加入未统计的“民营医院、私人诊所、村卫生室”,则中国药品终端总销售额约20000亿元。
二、我国药品流通品类现状占比
现化学药占比72.8%,本土和跨国生产商平分秋色。按药品类别分:根据商务部药品流通直报的35家企业的数据,2018年流通药品分类占比为:化学药占72.8%,中成药占15.2%,生物制品占7.9%,医疗器械占2.4%,其他品种合计占比2.7%。从近三年的销售变化趋势来看,化学药的占比仍在逐年增加,这就是我国化学药品医药市场泛滥的显著特点,而中成药占比不升反降,中国医疗器械市场近两年增速均达到40%以上,预计跟行业集中度提高相关。出现这一现象主要跟医保控费、限制辅助用药有直接关联,中医药的复兴道路坎坷。如要让中医药市场得到快速扩容而达到中央预定的30%,那可能要采取象这次抗新冠肺炎阻击战这样,排除一切干扰,以强有力的手段才能实现中医药大健康中国战略目标。
从目前市场当适应症药品类消费来看,消化道和代谢药品占比第一,为17%,其次是心血管、全身抗感染、抗肿瘤及免疫调节、神经系统等。
2018年,本土生产企业市场份额为49.2%,跨国生产企业市场份额为50.8%。国家基本药物占比为17.5%。医保药品占比为69.2%。
三、两票制改变了药品流通现状
两票制改变了药品流通格局,纯销占比提升。过去,药品流通业存在多重代理、挂靠走票等模式。繁复的流通环节抬高了药价,滋生了违法违规行为。多重代理:即药品从厂家到医院之间经过多重经销商层层转手挂靠走票:流通环节违法避税的手段。
2017年1月,卫计委等八部门联合发文,要求在2018年底之前全国推行两票制。截止2018年底,所有公立医疗机构如期实行两票制。两票制的执行减少了药品流通中间环节,规范了药品流通渠道,促进行业集中度提高。
两票制对批发企业的调拨业务占比从2016年的40.9%减少到2018年的29.9%,对医疗机构和零售终端的直接销售比例相应上升。
四、药品流通格局形成
截至2018年末,全国共有药品批发企业13598家,其中,全国性的流通企业分别是国药控股(市占率17%)、上海医药(市占率7%)、华润医药(市占率6%)、九州通(市占率4%)四家,其它为地方性的流通商。瑞康医药的药品配送业务主要在山东省内,该公司的医疗器械配送业务几乎覆盖全国所有省份,是全国性的医疗器械流通商。
目前,药品流通主要以国有背景企业为主。2018年,在全国药品流通直报企业中,国有及国有控股企业主营业务收入9541亿元,占总收入的60.5%;其次是股份制企业,收入占比为31.9%;外商、港澳台及私营企业合计占比为3.5%。
五、药品物流格局
根据中国医药商业协会医药物流数据库显示,2018年941家样本企业共有1476个配送网点,合计仓储面积为1296万平米,配送车1.79万台,冷库2856家。国控、九州通和华润的物流规模全国前三。物流中心面积、自有配送车辆、物流网点数量是反应配送企业规模的三大重要指标。物流中心面积为57%。排名前三的企业依次为:九州通、国控、华润,九州通物流中心面积达到246万平米。自有配送车辆为44%。排名前三的企业依次为:国控、九州通、华润,国控自有配送车辆为2678台。物流网点数量为47%。前三的企业依次为:国控、华润、九州通,国控的自有物流网点数量为282个。
六、药品流通企业的盈利能力
根据2018年财报数据,药品流通板块(不包括药店)毛利率为12.5%,净利率为2.9%,扣除非经常性损益后的为8.2%。其净利率约为生物医药行业平均净利率的一半,但扣非ROE与生物医药行业持平。
近年财务指标变化趋势,主要原因是两票制后,流通商的低毛利率调拨业务减少,直接从厂家拿货,提高了整体毛利率。销售费用率上涨明显,主要原因是企业为了提高终端渠道覆盖,加大了终端资源投入,以及销售费用率较低的调拨业务占比下降所致。管理费用率维持平稳,财务费用率略上升,与资金成本升高有关。
净利率在2018年略微下降,主要由于费用率升高幅度大于毛利率增加的幅度。扣非后ROE在2018年下降较多,主要是虽然净利润和净资产的增速均下降,但净利润的下降幅度比净资产的下降幅度更大所致。
七、医药流通领域发展趋势
2018年,全国药品流通市场规模为21586亿元,增速为7.7%,随着药品市场规模的扩大,全国药品市场规模增速逐渐降低。截至2018年,全国共有药品批发企业13598家。2012年高峰时期,药品流通企业数量达到1.63万家,后由于行业增速下降、兼并收购等原因回落。2015年开始实施的两票制进一步促进了行业整合,企业数量下降到1.30万家,此后小幅反弹。药品流通行业在2011年-2018年从34%增加到43%,集中度持续提高。
1、药品流通行业集中度持续提高的驱动因素。两票制执行后,流通链条缩短,同时具有上下游资源优势的大配送商获得新业务的几率更高。带量采购等政策导致药价持续下降,配送费用降低,大配送商具有规模优势,相对成本更低。现相当多的新上市创新药是对运输储存条件要求较高的生物药,大公司的软硬件设备更优,更易获得这部分业务。
2、医药电商蓬勃发展。自2014年出台《互联网食品药品经营监督管理办法(征求意见稿)》,医药电商行业有了指引规则后增长迅速。2018年,我国医药电商业务销售总额(不含A证)达到978亿元,同比增长33%。
医药电商准入由前置审批转为备案监察,2017年之前,互联网药品交易需要取得《互联网药品信息服务资格证书》,该证书分为A/B/C三种:A证的范围是第三方交易服务平台,例如天猫医药馆和京东大药房;B证如九州通;C证如一心堂网上药店。截止2017年9月30日,我国共发了52张A证、240张B证和682张C证。2017年,国家取消了《互联网药品信息服务资格证书》的前置审批,转为备案监察。
3、政策导向作用。医药品流通是承载大健康产业上下游发展的重要一环,对行业相关政策敏感性较强。近年来各项政策落地对药品流通行业的影响如下:
一是两票制和零加成已经在在全国落地执行,对药品流通行业的边际影响减弱;
二是药品招标由于配送费用根据药品销售额的一定比例收取,所以药价的下降也导致配送企业收入降低;
三是带量采购对药品配送企业产生影响,不仅是药价下降,配送费用下降,且在带量采购后,重新选择大企业集约化缩减配送商的数量,从而达到配送集中度提高。
四是药品审评审批上市进度加快,新药的价格较高,配送费用相对较高,给药品流通企业带来新的增量。
(信息来源:欧廷君)Top
伴随着斗转星移的花落花开,这个不同寻常的暖春让我们领略了逆境中的不屈与倔强。荆棘密布,仍在路上,蓦然回首,不觉春已逝,转眼夏伊始。过去的2019,美国生物类似药在一个个突破中继续成长,实现着一次次的自我超越,不知不觉中带来了一波波的惊喜与希望。
路虽远,行则将至。在上篇概述了美国市场生物类似药的市场概况、竞争格局、价格体系和专利诉讼等多个方面的基础上,本篇重点对具体产品进行解析。
■批准概况
2019年至今,美国又有10个生物类似药产品陆续获批、11个产品在和解求稳或曲折冒险中最终上市,两项数字均创下历年新高。一方面反映了近年来美国生物类似药体系逐渐健全后较为密集的申报数量,另一方面也体现了原研在由“一对一单挑”逐渐转变为“一被多围殴”后权衡之下市场策略的改变。同时巨大的商业利润也让多个对手偏向虎山行,选择了铤而走险的未和解上市。截至2020年5月中旬,美国以351(K)途径申报的生物类似药获批总数量和上市数量已经分别达到了26个和17个。


从产品种类看,已获批产品涵盖了非格司亭、促红细胞生成素、单克隆抗体和抗体融合蛋白四大生物产品种类,涉及9种具体的生物产品。随着今年3月23日FDA开始执行胰岛素、生长激素等此前以NDA途径注册的产品向BLA转换,未来美国市场生物类似药的种类将更加丰富,分类上进一步与欧盟接轨,变得更加严谨合理。这同时也对此前仅需以ANDA申报转换涉及产品仿制药的众多公司在成本、数据准确性、审评时长等多个方面提出了新的挑战。
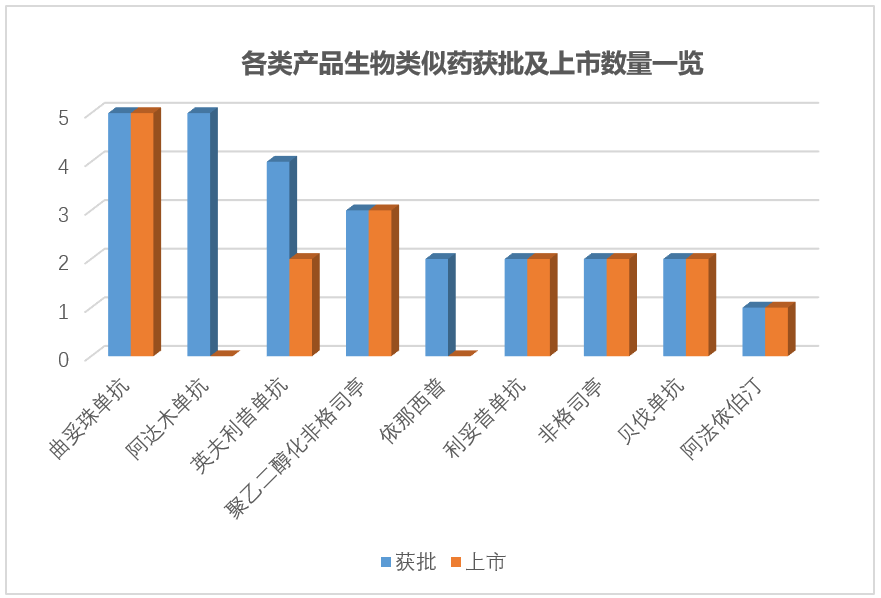

曲妥珠单抗等6个产品实现了已获批生物类似药的全部上市,阿达木单抗和依那西普生物类似药分别受限于和解条件和专利侵权至今未能上市。曲妥珠单抗和阿达木单抗获批生物类似药的数量并列第一,均为5个,但上市情况出现了“全和无”的鲜明对比,阿法依泊汀仅有1个生物类似药获批。
从获批产品涉及公司看,整体格局为“大佬领头+专家居中+小弟断后”,Pfizer以7个获批产品独占鳌头,说明不是所有药厂都能称宇宙;伯仲之间的生物制药圈儿四大魔王Amgen、Sandoz、Celltrion和Samsung紧随其后,说明还是要相信专业的力量;Mylan等三家垫底,但入围本身已是荣耀满满,非专业需要更多后天的努力和时间去积淀。

.png)
从审评进度看,产品的复杂程度以及申报资料的质量共同决定了FDA审评所需要的时间,Sandoz的聚乙二醇化非格司亭生物类似药Ziextenzo早在2015年即被FDA接受审评,直到2019年底才最终获批,前后历时近4年,获批耗时最久;BI的阿达木单抗生物类似药Cyltezo从接受审评到最终获批仅历时219天,成为最快获批的产品。从申报到接受审评一般还要历时2个月的时间,10个月以内获批基本已经是天花板。多家公司的BLA申请因为各种原因在审评过程中被FDA退回,审评进度收到了不同程度的影响。2018年Celltrion的利妥昔单抗和曲妥珠单抗两个生物类似药产品因GMP问题被拒,导致两个产品的审评总时间都超过了500天;同年Sandoz利妥昔单抗生物类似药同样被FDA退回补充数据,Sandoz最终决定放弃美国市场不再申报;貌似简单一点的原核产品聚乙二醇化非格司亭其实也没那么容易,目前已经上市的三家公司Coherus、Mylan和Sandoz的BLA均在审评阶段因数据不充分和不准确被退回。综上可见,产品的难易都只是相对而言,稍有不慎就会一朝回到解放前,靠谱的质量和工艺以及全面准确的数据永远是最重要的。
■产品解析
非格司亭:老骥伏枥,志在千里,烈士暮年,壮心不已
非格司亭的问世距今已有近30年,在生物药领域是当之无愧的大哥级产品,傲人的资历和良好的临床应用使其至今依然活跃在药界江湖,常青树的不老传奇依然还在继续,更重要的是在其身上诞生了美国历史上第一个真正意义上的生物类似药,具有里程碑式的意义。
Amgen的原研产品Neupogen于1991年2月在美国全球首发,上市后全球销售额在起伏中总体呈上升趋势,于2013年达到13.98亿美元的销售峰值,此后受美国市场萎缩影响其全球销售额开始逐年下滑,2019年全球销售额已降至2.64亿美元。美国市场是Neupogen最为重要的全球板块,近十年来占比大部分时间都在七成以上,直接影响着其全球整体表现。随着Teva以351(a)途径申报的Granix于2012年在美获批后上市,Neupogen逐渐受到冲击,其美国市场销售额于2014年开始下滑,2015年Zarxio的上市进一步使其雪上加霜,年收入下滑速度一度达到40%,2019年已降至1.78亿美元。

.png)
截至目前共有两家公司的非格司亭生物类似药在美国获批,分别为Sandoz的Zarxio和Pfizer的Nivestym,分别于2015年3月和2018年7月获批。Sandoz继拿下欧洲第一个生物类似药后,再次靠Zarxio把美国第一收入麾下,万事开头难,Zarxio标志着一个新的时代的到来,成长或许是漫长的,但迈出的第一步总是意义非凡的。同时Sandoz也开创了冒险上市的先河并以自身经历写下了美国生物类似药专利诉讼的第一笔,原来专利舞蹈也是可以选择不跳的,获批前5个月被诉、获批后半年上市,获批后四年最终胜诉,一系列堪称教科书般的操作战胜了对手、证明了自己、也鼓舞了后来人。Pfizer同样是审评中被诉,获批后不到3个月就选择了冒险上市,目前诉讼仍在进行中,后续庭审已推迟至2021年。Apotex的Grastofil报的不晚,中间诉讼也是一波三折,关键是BLA一直未批,最终选择了放手;Kashiv和Tanvex两家也分别于2017年和2018年提交了自己的BLA,目前均未获批,相关诉讼已经终止。
从市场销售情况看,Sandoz和Pfizer两家均由自身进行销售,Zarxio和Nivestym上市时的WAC价格分别为当时原研WAC价格的85%和70%。按照最新4月份公布的2020年第一季度ASP价格数据,Zarxio和Nivestym每1mcg产品的ASP价格分别为0.46和0.59美元,相当于目前原研产品Neupogen其ASP价格的52%和67%,相比于各自上市后最早ASP价格分别降低了49%和17%,Neupogen当前ASP价格为0.89美元/mcg,相比仿制药上市前自身价格仅下滑了6%。
IQVIA数据显示该产品2019年美国市场总销售额为5.17亿美元,总销量为242万支,共有西林瓶和预装注射器两种形式的包装,销量占比分别为21%和79%,除Sandoz只有预装式注射器包装外,其余各家均同时拥有上述两种包装形式的产品,从规格看,300mcg和480mcg两种产品基本各占一半。原研Amgen其2019年销量份额占比已下滑至33%,Sandoz份额为42%,排名首位,另外Teva和Pfizer占比分别为22%和2%。2020年第一季度Neupogen全球和美国销售额分别为0.65亿美元(-11%)和0.4亿美元(-20%)。
聚乙二醇化非格司亭:黄沙百战穿金甲,不破楼兰终不还
作为非格司亭部分适应症的2.0plus版,聚乙二醇化非格司亭通过对rhG-CSF蛋白进行聚乙二醇(PEG)修饰延长了药物在患者体内的代谢时间,提高了药物的生物利用度和稳定性,减少了每天反复注射的不便以及不良反应的发生,将每个化疗周期的用药频率缩减至一次,在临床应用上具有极为深远的意义。
.png)

Amgen在Neupogen问世后十年再次推出原研产品Neulasta,于2002年1月首先在美国获批,上市后全球销售额火力全开,于2015年达到47.15亿美元的销售峰值,此后受美国市场非格司亭生物类似药以及欧美外部分市场该产品自身生物类似药的冲击影响其全球销售额开始逐年下滑,美国和欧洲市场在2018年相继失手进一步加剧了原研品市场萎缩的速度。2019年全球销售额已降至32.21亿美元。同Neupogen一样,美国市场也是Neulasta的绝对核心区域,近年来在全球收入中占比都在八成以上,战略地位举足轻重。为了应对未来的竞争,Amgen在2015年率先在美国市场推出了更为方便使用的自动注射器新包装,在一定程度上抵消了部分生物类似药的竞争。尽管如此,大趋势无法改变,随着三家生物类似药的陆续上市,2019年美国市场收入骤减10亿,降至28.14亿美元。
截至目前已有三家公司的聚乙二醇化非格司亭生物类似药在美国获批,Mylan的Fulphila于2018年6月首家获批,7月即冒险上市,当时于2017年9月开始的诉讼仍无定论;2016年8月申报的Coherus于2017年5月被诉,其Udenyca于2018年11月获批,随后跟随Mylan脚步于2019年1月3日冒险上市;早在2015年便申报的Sandoz命运更为坎坷,其Ziextenzo直到2019年11月才最终获批,当时诉讼已经解决,上市与获批仅间隔了11天。三家公司与原研的诉讼最终均已胜利告终,但在FDA审评过程中均经历了因数据不完整等因素被退回重报的尴尬,三个产品从提交到获批历时最短也接近2年,Ziextenzo历时4年才最终获批,上市进程均受到了不同程度的影响。虽然是原核表达产品,该产品可以通过理化、功能、药代动力学和药效动力学等方面的比较研究推论出临床疗效的相似性与否,不需要单独在进行临床疗效研究,但PEG修饰的产品对均一性、纯度要求很高,工艺处理及质量控制依然具有一定难度。除本身的严要求高标准外,FDA审评时欧盟Neulasta生物类似药尚无先例可寻,其审评态度也更加谨慎。
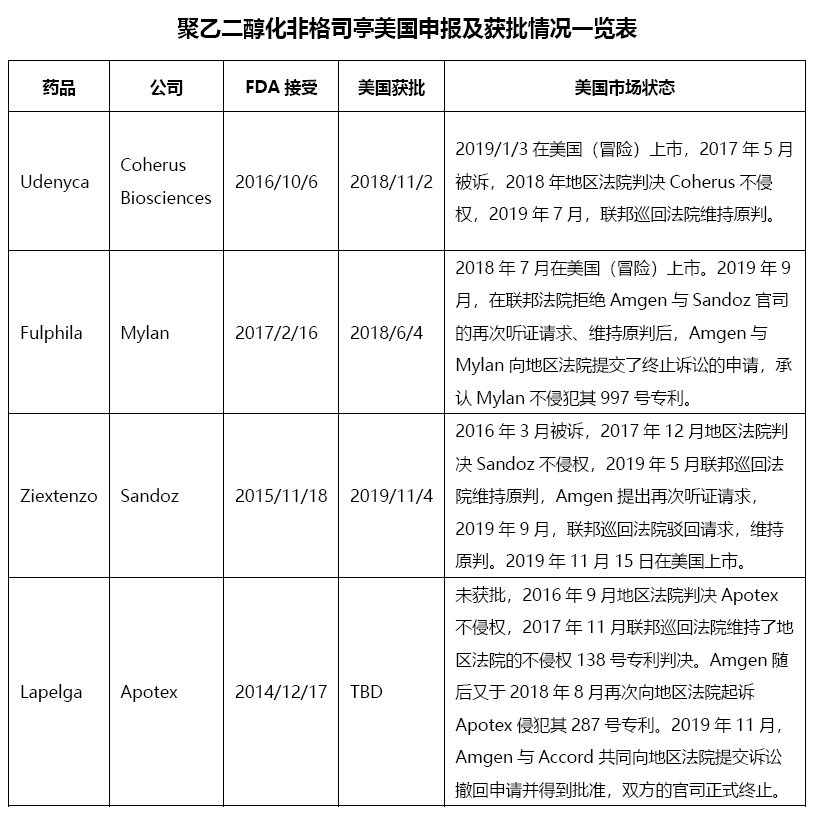

除目前已经获批的三家公司外,针对美国该产品进行布局的还包括了最早申报仍未获批的Apotex/Accord,已经完成I期临床试验的Adello和目前正在与Amgen进行专利诉讼的Fresenius,以及正在进行I期临床试验的Pfizer,此前报道的Pfenex因经费问题已经暂停了该项目,Lupin等印度公司此前据报道也在针对美国市场开展了相关工作。从目前的情况看,已获批三家生物类似药的局面将维持一段较长的时间,短期内不会有新的生物类似药上市。
从市场销售情况看,已上市三家产品均由自身进行销售,Fulphila和Udenyca上市时的WAC价格均为各自上市时原研WAC价格的67%,Ziextenzo则为63%。按照最新的2020年第一季度ASP价格数据,Fulphila和Udenyca的ASP单支价格分别为3481.39美元和3643.57美元,相当于目前原研产品Neulasta其ASP价格的93%和97%,相比于各自上市后最早ASP价格分别降低了17%和10%,Neulasta当前ASP单支价格为3757.68美元,相比仿制药上市前自身价格下滑了15%,Ziextenzo上市较晚暂无数据。
IQVIA数据显示该产品2019年美国市场总销售额为39.8亿美元,总销量为124万支,三个生物类似药均为预装注射器包装,原研同时拥有预装注射器和自动注射器两种包装形式,后者的销量占比已经达到原研最量的70%;原研总销量为100万支,依然占据着80%的市场份额,Fulphila和Udenyca销量份额分别为7%和13%。Coherus年报显示Udenyca其2019年销售收入为3.56亿美元,该产品近五年研发费用已达到1.6亿美元。2020年第一季度Neulasta全球收入继续下滑至6.09亿美元(-40%),其中美国市场收入为5.34亿美元(-40%),Udenyca第一季度美国市场收入则为1.16亿美元(+213%)。
贝伐珠单抗:明知山有虎,偏向虎山行
作为Roche的经典抗肿瘤三件套之首,原研产品Avastin于2004年2月首先在美国获批上市后全球销售额在微小的起伏中总体呈上升趋势,于2019年达到了70.73亿瑞士法郎(约合71.3亿美元)的历史销售峰值,再次跻身全球TOP10。美国市场收入虽不是历史最高,但已经是近4年的最佳表现,稳定的贡献了全球收入中的42.7%,在开始面临生物类似药竞争的情况下交出了一份不错的答卷。随着各主要市场生物类似药的不断渗透,2020年第一季度Avastin全球收入同比下滑13%后降至14.97亿瑞士法郎,美国市场收入(5.86亿瑞士法郎)下滑更是达到了27%,或许2019年的表现将成为Avastin最后的高光时刻,但昔日的光芒已经足够闪耀,迟暮的英雄依然可以骄傲地昂首离开。
Amgen的Mvasi和Pfizer的Zirabev分别于2017年9月14日和2019年6月27日获得FDA批准,成为美国351(K)途径下获批的第7和第21个生物类似药。Mvasi获批即被诉侵权24个专利,2019年7月18日,Amgen选择了在美冒险上市该产品,如今官司已经持续了两年半的时间仍无定论,双方的下一场口头辩论将于今年6月份进行;Zirabev尚未获批就被告上法庭的Pfizer则选择了另外一条道路,被诉仅5个月后就与原研Roche达成了和解并于2019年12月31日正式在美国上市了该产品。除Amgen和Pfizer两家已获批的产品外,Samsung Bioepis和Mylan两家的该产品生物类似药也分别于去年申报,目前正处于FDA审评过程中,最快有望于今年获批。百奥泰的贝伐单抗生物类似药BAT106已完成三期临床,有望于今年在美国申报BLA,Celltrion、Amneal/MAbxience和Centus Biotherapeutics等其他家的该产品生物类似药也已处于三期临床或即将开启三期临床阶段。信达生物于今年年初将该产品的美国市场商业化权益授权给了Coherus,有望最快于今年年底申报FDA。
从市场销售情况看,Amgen和Pfizer上市时的WAC价格分别为当时原研WAC价格的85%和77%,按照最新的2020年第一季度ASP价格数据,两家产品差别不大,Mvasi和Zirabev的每10mg产品的ASP价格分别为59.1美元和59.6美元,相当于目前原研产品Avastin其ASP价格的78.8%和79.4%,Mvasi相比于上市后最早ASP价格降低了10%,Avastin当前ASP价格为75.1美元/10mg,相比仿制药上市前自身价格仅下滑了2%。
IQVIA数据显示该产品2019年美国市场总销量为194.6万支,100mg和400mg占比分别为51%和49%,原研在此前的单支装基础上于2019年推出了10支的新包装,全年销量份额达到了96%;Amgen的Mvasi在2019年的销量仅为8万支,短期内还很难对Avastin构成威胁,其年报公布的2019年该产品美国市场销售收入为1.21亿美元,2020年第一季度收入进一步提升至1.08亿美元,总体表现令人满意。
曲妥珠单抗:雕栏玉砌应犹在,只是朱颜改
曲妥珠单抗的问世为其它肿瘤特异疗法的开发扫清了障碍,开启了单抗靶向疗法的新篇章,在药圈儿中拥有着极高的历史地位。作为Roche抗肿瘤三件套之一的原研产品Herceptin于1998年9月首先在美国获批上市,其全球销售额一路飙升,于2017年达到了70.14亿瑞士法郎(约合71亿美元)的历史销售峰值,随后开启了夕阳红模式,2019年全球销售收入已下滑至60.39亿瑞士法郎(约合61.97亿美元)。2020年一季度继续走低,全球销售收入为12.07亿瑞士法郎,同比下降了24%。如果说Humira和Avastin至少暂时分别保住了美国和欧洲市场,赢得了暮年终极一战的机会,Herceptin则是欧美双线沦陷,生物类似药双管齐下的强力推进之势已经无法逆转。美国市场在Herceptin全球收入中的占比并不高,直到欧洲失守后才在2019年达到45%,但多年来持续稳定的增长着实为Herceptin全球版图的延续贡献了巨大的力量。2019年7月生物类似药开始登陆美国市场,更是在新年交替之际遭遇夺命4连击,2020年一季度美国市场收入同比下滑38%,已降至4.75亿瑞士法郎。出来混总是要还的,只是这顿组合拳来的令人太过惆怅。
2017年12月至2019年6月,Mylan等五家公司的曲妥珠单抗生物类似药相继获得FDA批准,其中Mylan、Celltrion、SamsungBioepis和Pfizer均与原研和解,于2019年12月2日起陆续在美国市场上市。跟Avastin一样,一不做二不休的Amgen在诉讼尚未解决的情况下于2019年7月冒险首家上市了其生物类似药Kanjinti,首仿的利益驱使只是一方面,更多的还是对诉讼本身持有的自信和乐观态度。
从市场销售情况看,Celltrion和Samsung Bioepis两家韩国公司的产品分别由合作伙伴Teva和MSD进行销售,另外三家均自行销售各自产品。Ogivri、Ontruzant和Kanjinti上市时的WAC价格分别为当时原研WAC价格的85%,Herzuma和Trazimera则分别为90%和78%。按照最新的2020年第一季度ASP价格数据,Kanjinti和Ogivri的每10mg产品的ASP价格分别为77.3美元和85.5美元,相当于目前原研产品Herceptin其ASP价格的79%和87%,Kanjinti相比于上市后最早ASP价格降低了9.7%,Herceptin当前ASP价格为98.3美元/10mg,相比仿制药上市前自身价格仅下滑了2.6%。剩余三家的产品于2020年第一季度才登陆美国市场,暂时没有ASP价格公布。
IQVIA数据显示该产品2019年美国市场总销量为249万支,150mg产品占据主导地位,原研在此前的单支装基础上于2019年推出了10支装新包装,全年销量份额达到了98%;Kanjinti和年末上市的Ogivri两个产品在2019年的销量仅为3.5万支,随着三家新生物类似药的近期陆续上市,Herceptin收到的冲击从2020年第一季度将逐渐增强,Amgen其年报公布的2019年Kanjinti美国市场销售收入为1.18亿美元,2020年第一季度收入已达到0.96亿美元。
利妥昔单抗:他时若遂凌云志,敢笑黄巢不丈夫
作为全球第一个上市的抗肿瘤单抗,利妥昔单抗开创了淋巴瘤靶向治疗的先河,改变了此前只能通过化疗进行一线治疗的旧格局,同样意义非凡。Roche的原研产品Mabthera/Rituxan(分别用于欧洲和美国市场)于1997年11月在美国获批,是三件套中最早上市以及历史销售峰值最高的产品。Rituxan上市后全球销售额保持持续增长,于2017年达到73.88亿瑞士法郎(约合75亿美元)的销售峰值,此后由于欧洲市场沦陷开始步入下坡,2019年全球销售额已降至64.77亿瑞士法郎(约合65.3亿美元)。近五年来,美国市场收入占比一直维持在一半以上,2019年达到最高的69%。美国市场生物类似药从2019年底进入市场,去年收入并未收到影响,达到了历史最高的44.88亿瑞士法郎(约合45.2亿美元)。2020年第一季度,美国市场开始出现下滑,季度收入(9.73亿瑞士法郎)同比降低了14%,全球季度收入(13.89亿瑞士法郎)也同步下滑了15%。
Celltrion和Sandoz均于2017年向FDA提交了该产品生物类似药的BLA,Sandoz于2018年5月收到FDA的CR letter,需要进一步补充数据后重新提交,考虑到耗费精力巨大,权衡之下Sandoz于2018年11月宣布将不再向FDA申报该产品。其实早在Sandoz申报美国之前,该产品就已经在欧盟获批,同样的数据却得不到欧美两国监管机构的共同认可,着实也是一件很无奈的事情。拂袖而去的Sandoz着实有些悲情,利妥昔被拒,聚乙二醇化非格司亭历时4年才批,阿达木单抗暂时上不了,依那西普更是被安进的专利牢牢锁死,具有里程碑意义的非格司亭或许是其目前唯一慰藉,天降大任之前总要苦其心志一番,永远不要低估一颗一哥的心。拿到欧洲首仿的Celltrion在Truxima即将获批前即与Roche达成和解,其产品已于2019年11月11日在美国上市。2018年第二波提交的Pfizer也于去年其产品获批前与Roche达成了和解,Ruxience在2020年1月23日正式在美上市。Amgen于去年12月向FDA提交了BLA申请,如果一切顺利有望在今年获批。
从市场销售情况看,Celltrion的产品同样由合作伙伴Teva进行销售,Pfizer自行销售其产品。Truxima和Ruxience上市时的WAC价格分别为当时原研WAC价格的90%和76%。按照最新的2020年第一季度ASP价格数据,换算后Celltrion其100mg和500mg产品的ASP单支价格分别为821.62美元和4108.11美元,相当于原研产品Rituxan其ASP价格的92.5%。Ruxience于2020年第一季度才登陆美国市场,暂时没有ASP价格公布。
IQVIA数据显示该产品2019年美国市场总销量为231.4万支,100mg和500mg两个规格产品占比分别为57%和43%,原研在此前的单支装基础上于2019年推出了10支装新包装,全年销量份额达到了98.5%,年末上市的Truxima在2019年的销量仅为3.5万支。
英夫利昔单抗:欲渡黄河冰塞川,将登台行雪满山
肿瘤圈儿有着耳熟能详的罗氏三件套,类风湿关节炎领域同样有着名闻天下的TNF-α三剑客,带头大哥英夫利昔单抗作为全球第一个TNF-α抑制剂,开启了自身免疫性疾病治疗的新纪元。与阿达木单抗和依那西普两个小弟相比,英夫利昔单抗多少有点“既生瑜,何生亮”的感觉,限于产品本身为需静脉注射的人鼠嵌合抗体,其在安全性、便捷性和治疗成本等多个方面均处于下风,正所谓“长江后浪推前浪,他比后浪还要浪”。
英夫利昔单抗长期处于J&J、Merck和Mitsubishi Tanabe三家共治的局面,有时候收购可以让很多事情变得简单,但有时也会带来不少烦恼的麻烦。原研产品Remicade于1998年登陆美国市场,此后全球销售额不断飙升至无限接近百亿大关,巅峰时也是位列全球三甲,2014年后开始逐年下滑至2019年的53.3亿美元。美国市场一直由J&J负责销售,近年来在全球销售中占比一直在60%以上。作为最早一批有生物类似药进行申报的产品,Remicade早在2016年便已经开始在美国市场面临生物类似药竞争,2017年美国市场销售额开始下滑,2019年降至33.73亿美元,占比63%。
截至目前已有四家公司的英夫利昔单抗生物类似药在美国获批,2016年4月首家获批的Celltrion在BLA审评阶段即被诉侵权,获批后半年多于2016年10月冒险上市了Inflectra,诉讼至今仍在进行中;2017年4月第二家获批的SamsungBioepis在获批后3个月同样选择了在专利诉讼未解决的情况下冒险上市Renflexis,不同的是同年11月双方达成一致后已经撤诉;2017年12月获批的Pfizer考虑到其收购的Hospira已经与Celltrion合作销售其已在市销售的产品,最终放弃了其自身产品Ixifi的上市;最后一家Amgen的Avsola于去年12月刚刚获批,目前尚未有明确的上市计划。
从市场销售情况看,Celltrion和Samsung Bioepis的产品分别由合作伙伴Pfizer和MSD进行销售,Inflectra和Renflexis上市时的WAC价格分别为当时原研WAC价格的85%和65%。按照最新的2020年第一季度ASP价格数据,换算后Celltrion其100mg产品的ASP单支价格分别为450.75美元,Renflexis价格略高为470.3美元,分别相当于目前原研产品Remicade其ASP价格的86%和90%,相比于上市后最早ASP价格降幅均超过了35%。Remicade当前ASP价格为52.5美元/10mg,相比仿制药上市前自身价格已经下滑了33%。
IQVIA数据显示该产品2019年美国市场总销量为806万支,原研J&J、Pfizer和Merck三家份额占比分别为90%、7%和3%。两家生物类似药上市已在3年以上,虽然带动了市场整体价格的下降,但在销量上对原研造成的冲击比较有限,原研J&J通过增加回扣返点等方式遏制仿制药渗透,生物类似药的渗透效率与上市时间相比依然低于预期。Inflectra其2019年全球收入为6.25亿美元(-3%),其中3亿美元(+16%)来自于美国市场。2020年第一季度,Inflectra全球收入和美国市场收入分别为1.58亿美元(+14%)和0.84亿美元(+46%)。
依那西普:风萧萧兮易水寒,壮士一去不复还
作为TNF-α三剑客中的二哥,身背全球首个融合蛋白药物的光环,依那西普紧随大哥英夫利昔单抗的脚步闪亮登场,将提高功能蛋白的稳定性、延长体内代谢时间和形成高效靶向集聚一身,开辟了一条部分相似但不尽同于单抗的新的道路。
最初由Immunex开发的原研产品Enbrel于98年全球首发,同样的时间,相似的剧情,一系列授权和收购的组合拳后,最终于去年底尘埃落定的回到Pfizer和Amgen两家双足鼎立、划江而治的状态。Enbrel问世以来全球销售收入高歌猛进,于2016年达到92.54亿美元(Amgen+Pfizer+Takada)的历史年销售额峰值,一度冲进全球三甲,由于其核心美国市场在专利铁通阵的防护下至今固若金汤,近年来状态虽有下滑也一直是TOP10的常客,2019年依然交出了72.5亿美元的不错答卷。随着美国以外市场专利到期后逐渐萎缩,美国市场为其全球总收入贡献比例逐步增加,2019年已达到70%。Enbrel美国市场在没有生物类似药进入的情况下更多的来自于同领域其他产品的竞争,其美国市场收入于2016年达到57.19亿美元的峰值后开始在起伏中逐渐回落,2019年收入为50.5亿美元,相比上年的略有提升更多的建立在不断提价的策略之上。
截至目前,FDA共批准了两个Enbrel的生物类似药,分别为Sandoz的Erelzi和SamsungBioepis的Eticovo。如果说审评多年不批就像表白多次无果,爱而不得,是一种不见却无法忘却的相思之苦,那么获批多年却无法上市就像在一起多年却不让牵手,得而不爱,是一种可远观而不可亵玩焉的绝望之伤,很不幸这两种刻骨铭心之痛都让Sandoz经历了。早在2016年8月便首家获批的Erelzi在获批前半年被诉,至今无法上市,Amgen凭借US8063182和US8163522两个传说中授权前不公开和到期日晚的“潜水艇专利”将生物类似药的上市之路牢牢封死,2019年8月Sandoz在地区法院败诉,专利限制将持续到2029年,之后Sandoz又上诉至联邦巡回法院,目前诉讼仍在进行中,一旦再次败诉,Sandoz将翻盘无望。Eticovo于2019年4月获批,Samsung Bioepis随后立即被诉,涉及包括上述两个“潜水艇专利“在内的5个专利,目前诉讼仍在地区法院阶段进行中,上市同样遥遥无期。除Sandoz和Samsung Bioepis两家外,针对美国市场开发该产品的公司还有Coherus和Lupin,前者三期临床已经结束,限于专利到期较晚,不会过早申报及寻求专利到期前上市,后者与Mylan合作的该产品即将在欧盟最终获批,计划于今年申报美国。
美国在售的原研品Enbrel包括了西林瓶(粉针剂)、预装式注射器、预装式卡式瓶以及预装式注射笔四类包装形式,将注射剂的包装做到了极致。IQVIA数据显示原研品Enbrel其2019年美国市场总销量为716万支,其中注射笔产品占比达到了63%,注射器产品占比22%,西林瓶产品占比最小,仅有5%的销量份额。Enbrel官网公布的WAC价格为每50mg产品1389.24美元。Amgen刚刚公布的季报显示Enbrel的2020年第一季度全球收入为11.53亿美元,同比基本持平,其中美国市场收入为11.17亿美元,占比97%。
阿达木单抗:江山如此多娇,引无数英雄竞折腰
作为全球第一个全人源化单抗,三剑客中最晚出道的药王Humira其光辉履历已无需赘述,出道十年加冕登基,一次次独孤求败得超越着过去的自己,如今又一个十年即将过去,功力有所减退,但王位依旧无可撼动,唯一的遗憾只恨距离200亿的那一步之遥。2019年,Humira全球销售额自上市以来首次出现下滑,然而191.69亿的数字依然充满了无敌的寂寞。一个名次的差距有多大?那是一个贝伐单抗的距离。
Humira傲视群雄的背后是美国市场稳定持续的优异表现对其强有力的支撑,2003年上市至今其十六年来美国市场销售收入的年复合增长率达到了近30%,贡献了2019年全球销售收入的近80%。早在2016年,原研Abbvie就已经开始了捍卫这片兵家必争之地的专利保卫战,报一个诉一个,车轮大战劲爆十足。历时一年多的拉锯战搞得大家都很疲惫,权衡之下的Abbvie最终选择了弃欧保美的策略,陆续与9家公司达成了阿达木单抗生物类似药欧美上市的和解协议,为美国赢取了5年宝贵的续命时间,将生物类似药最早进入美国市场的时间成功的限制到了2023年1月。有失才有得,能退方能进,取舍之间方显英雄本色。
截至目前,已和解公司中Amgen等5家的BLA已经获批,Coherus预计最快将于今年下半年申报,而Momenta则在一声叹息后有些无奈的选择了放弃。刚刚公布的Abbvie2020年一季度财报显示Humira一季度全球销售额为47.03亿美元,其中美国市场收入为36.56亿美元,占比78%。两项数字同比增长分别为13.7%和5.8%,表现令人满意。美国市场的涨价策略还在延续,一定程度上较好的缓冲了其他市场由于生物类似药竞争带来的销售下滑,接下来的此消彼长又将如何,让我们拭目以待。IQVIA数据显示该产品2019年美国市场总销量为953万支,连续保持增长状态,包括了预装式注射器和预装式注射笔两种包装形式,其中注射笔销量占比达到85%。
阿法依伯汀/依泊汀α:千淘万漉虽辛苦,吹尽狂沙始到金
DNA重组技术在80年代大放异彩,人胰岛素、人生长激素和干扰素等一系列生物产品应运而生、群星璀璨,血红细胞生成素(EPO)同样诞生在这个黄金的时代,其问世极大地推动了肾衰等多种原因引发的贫血症的临床治疗,使稳定量产和安全经济成为可能,在生物制药领域具有划时代的意义。
作为Amgen的生物药开山之作,原研产品Epogen意义重大,其研发历程充满了曲折,在项目濒临砍掉前取得成功的同时也迫不得已付出了“割地换资”的代价,部分亚洲(无适应症限制)和美国市场(肾脏透析贫血症以外适应症)分别被授予前后两次于危难之际注资的J&J和日本麒麟,雪中送碳也好,趁火打劫也罢,拨云见日之前经历的风雨并不是只有研发本身的呕心沥血。1989年首先在美国获批上市后,三家公司共同销售的原研产品不断刷新自身全球销售记录,于2002年达到历史销售峰值65.3亿美元,此后开始逐年下滑,2019年三家原研产品总销售收入已降至16.6亿美元。Amgen在美国以Epogen商品名销售,J&J则在美国以Procrit的商品名进行销售,近年来美国市场收入持续下滑,但在全球占比都在80%以上,2019年总收入为13.72亿美元,Amgen和J&J分别贡献了8.67和5.05亿美元。
截至目前,美国市场只有Pfizer一家的生物类似药Retacrit获批,该产品早在2014年12月便已申报FDA,中间因数据不充分和厂房GMP问题分别于2015年和2017年两次被拒,直到2018年5月才最终获批,前后历时近3年半。当时还未被Pfizer收购的Hospira于2015年9月被诉其在2013-2015年间生产的21批原液中的14批侵权其诉讼时已经过期的US5856298号专利,之后在地区法院判决其侵权且需要赔付Amgen 7000万美元外加利息的情况下于2018年11月在美国上市,联邦巡回法院于2019年12月维持原判并在今年年初驳回了Pfizer再次听证的申请。
从市场销售情况看,Retacrit目前在美国市场由Pfizer自身和合作伙伴Vifor共同销售,后者负责该产品在透析市场领域的销售。Retacrit上市时每1000 units的WAC价格为11.03美元,比Epogen和Procrit分别低了33.5%和57.1%。按照最新的2020年第一季度ASP价格数据,Retacrit每1000 units的ASP价格为8.69美元,相比上市之初最早的ASP价格下滑了19%,相当于目前原研品Epogen其ASP价格的92%。Epogen当前ASP价格为10.02美元/1000units,相比仿制药上市前自身价格已经下滑了18%。
IQVIA数据显示该产品2019年美国市场总销量为957万支,Epogen、Procrit和Retacrit三个产品的份额分别为57%、24%和19%,均为西林瓶包装。Pfizer年报显示Retacrit其2019年销售收入为2.25亿美元,Epogen、Procrit和Retacrit三个产品2020年第一季度的美国市场销售额分别为1.55亿美元(-29%)、0.76亿美元(-48.5%)和0.66亿美元(+371%)。
■未来展望
BPCIA法案自生效至今已有十年,具有里程碑意义的Zaxio正式登陆美国市场距今也已经过去了近5个年头,在隔壁小分子化药和欧洲生物类似药两个邻家兄弟的光环笼罩下,美国生物类似药的前进多少有些步履蹒跚,荆棘密布的大背景下,逆风前行之初便注定是一场破冰之旅。至千里总要积跬步,不同的起点和跑道,一样的理想与信念。复杂的商业渠道、漫长的专利拉锯、保守的政策法规,一系列涉及多个领域的影响因素共同制约了美国市场生物类似药的发展速度,邻家孩子的宝贵经验注定不能被完全照搬。
在专利方面,原研公司摆大巴般的铁桶阵将产品涉及的结构、工艺、用途等多个方面包裹地密不透风,生物类似药很难轻易突破这道屏障,专利舞蹈可以选择不跳,但专利之战注定惨烈,即便最后胜出也要伤痕累累,在产品尚未实现盈利的情况下提前为漫长的诉讼付出了宝贵的时间和金钱。Abbvie为保护Humira煞费苦心的在美国市场布局了200多个专利,这一数字是其欧洲产品涉及专利数量的3倍,和解换来了美国市场五年的和平更是数百亿美元的收入,封王的背后除了良好的临床应用及不断扩大的适应症范围带来的需求上量,还有多年来不断芝麻开花节节高的价格上涨,最终还是要由患者和保险来买单。令人期待的生物专利透明法案已于去年被提出,旨在仿照小分子化药使原研公司将生物产品的专利在紫皮书上予以公开,通过增加专利透明度降低生物类似药面临的专利障碍,出发点不错,但也有可能会激起原研公司列出更多专利加以阻挠,让专利舞步更加举步维艰。未来与否,拭目以待。
在市场方面,美国商业流通渠道纷繁复杂,整个流通链上分布着药企、批发商、PBM、保险公司、药房和患者等多方,生物类似药在近年来发展中很难满足多方的利益需求。多家原研公司通过在提供高额的回扣(最高达到WAC价格的50%以上)与主要保险公司及其PBM在生物类似药进入市场前签订了排他性的独家合作协议,要求保险公司将生物类似药排除在其报销清单之外。生物类似药上市之初很多无法提供回扣同时其价格相比原研产品的差距相对较小,无法达到小分子产品领域的断崖式降幅,如首选生物类似药反而将导致保险公司更高的花费。通过上述被业界成为“回扣陷阱”的刺激性策略,很多生物类似药即便上市也很难与原研品通过价格公平竞争。以英夫利昔单抗为例,生物类似药早在2016年便已上市,但至今原研品Remicade依旧占据着90%的市场份额。原研公司J&J于2017年和2018年先后被Walgreen和Kroger两大药房以及竞争对手Pfizer因不公平竞争告上法庭,FTC也曾介入调查,目前看这一问题难以短期内迅速解决。
在终端领域,生物类似药对于降低患者开支的作用低于预期,选择原研品和生物类似药在保险报销以外的实际个人付费上并没有明显差异,现有报销政策特别是商业保险更激励医生去选择价格更高的原研药已获得更高的报销金额。排除经济因素,选择生物类似药意味着更多额外工作的增加,在患者保险覆盖生物原研药且更换生物类似药并不会显著减轻经济支出的情况下,医生很难主动选择生物类。另外,生物类似药的宣传力度还不够深入,美国医生对于原研产品的认知根深蒂固,很多医生对于生物类似药知之甚少更不用提主动开具。加强医生领域对于生物类似药的认知和接受是未来亟待解决的问题,需要更大的宣传力度和涉及面。
在监管层面,现已获批的美国生物类似药均需要提交额外的临床研究数据来证明其替代原研产品的安全性进而获得FDA授予的可互换资格,无法像小分子仿制药那样实现药房层面的自动替换也是当前限制生物类似药迅速上量的重要原因之一。2019年5月,FDA发布了生物类似药原研互换指南,进一步明确了可互换资格获取的路径及相关要求和注意事项,着力避免未来相关研究费力不讨好同时能够更加有的放矢。目前不少公司也已经在开展相关的工作,冲破这层障碍距离未来生物类似药的真正起飞也就的不远了。
综上:“保险不愿接、医生不愿开、患者不愿用、药房不能换”的各方面综合因素共同限制了过去五年来生物类似药在美国市场的渗透速率,生产商一厢情愿的爱终究无法冲破大环境的束缚收获真正的幸福。绝大多数已上市生物类似药的表现并不尽如人意,使得生物类似药整体在节约医疗开支方面的贡献远低于预期。可喜的是在政府、监管机构、流通领域以及药企自身的共同努力下,各个环节都取得了明显的进步,至少已经在清楚症结所在之后走在了正确的修复之路上。路漫漫其修远兮,比之欧盟走过的十余年,美国生物类似药还仍显稚嫩,但正是因为年轻的无畏赋予了未来更多无限的可能,点滴积累起的惊喜依然让明日之路值得憧憬与期待。
(信息来源:医药魔方)Top
海龙:近日市场有商咨询购货,带动货源走动好转,行情仍保持坚挺,目前市场刁海龙价格在16000元/千克,尖海龙900元上下,拟海龙1000元上下。
海马:近日市场来货量不多,有商家组织货源,带动行情稍有好转,目前市场大海马价格在11000元/千克,小海马价格在6500元左右。
雷丸:市场经营商家不多,货源以正常需求消化为主,整体购销平稳,行情平稳运行,目前市场雷丸统货售价160-180元/千克。
龙血竭:近期市场需求商家不多,货源以零散需求消化为主,行情平稳运行,目前市场龙血竭国产统货售价300-320元/千克。
漏芦:近日市场来货量充足,有商家咨询购货,小批量货源成交为主,大量库存还需进一步消化,行情暂稳,目前市场漏芦统货价格在17-18元/千克。
绵马贯众:近日市场虽有商家咨询问货,但实际入手的商家不多,货源走动减缓,行情恢复平稳,目前市场东北统片货价格在12-14元/千克。
白芍:近日市场寻货商家依然不减,药厂货走动尚可,由于可供货源充足,行情仍疲软运行,目前市场白芍一二级货售价16-17元/千克,二三级货15-16元上下,三四级货10-11元上下,统货11元上下,小尾芍价格在3-4元。
白术:市场可供货源量仍很充足,近期缺乏大货需求消化,行情显得疲软,目前市场白术安徽统货售价14-15元/千克,选货价格在16.5元上下;浙江统货23元上下。
(信息来源:康美中药网)Top
草果:草果近几年行情一直震荡运行,前期说天旱,关注商增多价坚挺,因影响不大,加之今年大环境不佳,近期行情疲软下滑,现市场价格在37-39元,后市行情仍难平稳。
川芎:川芎随着产地产新深入,专营商正常购销,行情显疲,现市场川芎价格在16元左右,此品销量大,产地又集中,后市行情仍有波动可能。
艾叶:艾叶产地多,市场多专营,近年来艾产品需求增加,行情也较为坚挺,现市场艾叶价格在7-8元,后市行情以稳为主。
藿香:霍香前期价涨刺激种植,生产量增多,专营商积极销售,价格下滑,现市场藿香价格在15-17元。此品经过疫情消化,库存不大。
威灵仙:威灵仙今年北朝进口货少,国内产新量也不大,价格坚挺,现市场统货价格在36-38元,后市货源上市情况需要关注。
蛇床子:蛇床子近几年价低,关注商增多,行情坚挺,现市场价格在13-15元,后市行情需关注产新情况明朗。
韭菜子:韭菜子因有过高价,前期有商视价低入手,但销量小,时下进入淡季,行情平稳,现市场价格在24元左右,近期行情以稳为主。
(信息来源:康美中药网)Top
我们的一切努力都是为我们的客户——
提升竞争优势,共同创造持续长远的收益
| 

.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)
.png)


.png)
.png)
.png)

