|
1类新药申报再创高峰 免疫疗法大热!恒瑞稳居首位
医药网2月2日讯
1类新药承办情况
2018年CDE共承办1类新药注册申请545件,约涉及263个通用名(2017年为215个)。2018年是化学药品注册分类改革的第二年,在鼓励新药研发的环境下,近几年1类新药申报数量稳步上升。
图1:2016-2018年1类新药申报情况(按受理号)
近几年抗体药物以及肿瘤免疫治疗领域迅猛发展,生物制品类的新药研发热情高涨,2018年CDE承办的1类新药申请中生物制品占比进一步扩大。
图2:2016-2018年1类新药药品类型占比变化情况
2018年抗肿瘤和免疫调节剂仍是1类新药申报的热门领域,其次是抗感染药。而在抗肿瘤药和免疫调节剂中又以PD-(L)1和CAR-T最为热门。
图3:2018年CDE承办1类新药各治疗领域占比情况
从企业角度看,2018年申报1类新药超过3个的企业有17家。恒瑞医药依然稳居首位,在2018年共申报了10个1类新药。中科院上海药研所、百济神州和信达生物均有4个1类新药进入CDE。
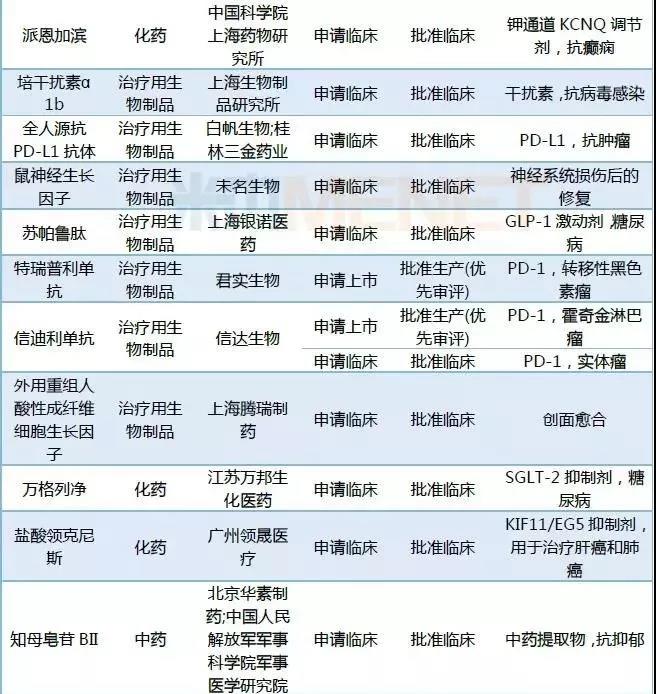
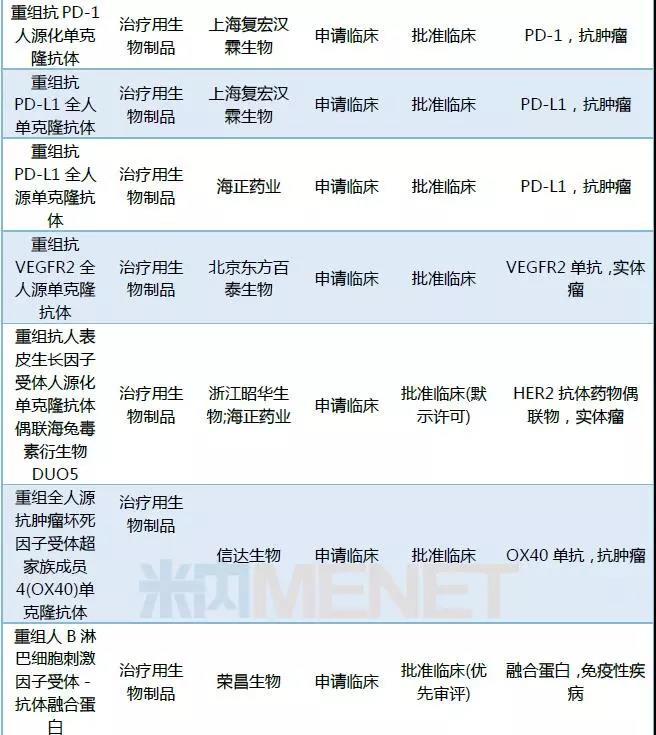
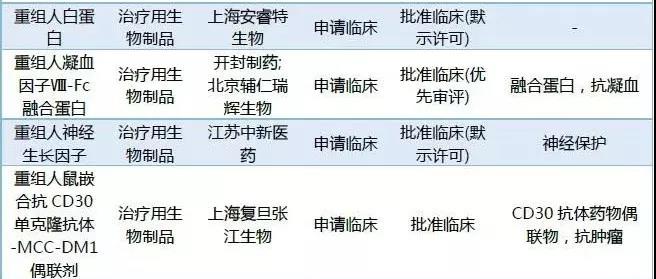
2018年CDE承办的1类新药中有26个药品被纳入优先审评。Alnylam的Fitusiran,荣昌生物的重组人B淋巴细胞刺激因子受体-抗体融合蛋白,开封制药重组人凝血因子Ⅷ-Fc融合蛋白以及北京诺宁生物的重组十四价人乳头瘤病毒疫苗为临床申请,其它药品均为上市申请。
表1:2018年1类新药纳入优先审评情况
审批进展
国家药监局在2018年7月发布了《关于调整药物临床试验审评审批程序的公告》,药物临床试验审评审批制度由审批制变为60日默示许可制,临床申请审批速度大大提升。截至数据统计日,2018年申报的1类新药申请已有超过40%的受理号完成审评审批。
图6:2018年CDE承办1类新药审批进展
截至数据统计日期,2018年申报的1类新药中有133个药品获批临床,2个药品获批生产。(点击查看2018年新药获批情况)
表2:2018年CDE承办1类新药审批情况
数据来源:米内网MED中国药品审评数据库
数据统计截至2019年1月
相关药品治疗领域/适应症信息均整理自行业公开资讯
| 

.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)
.jpg)