|
自2017年12月第一批产品获得一致性评价称号以来,CFDA和CDE相继发布第十二批参比制剂、过度重复目录、注册批生产规模文件,并于2月14日连续发布第十三批参比制剂与第二批通过一致性评价品种目录。上述文件都将影响化学药仿制药注册和一致性评价的申报,但尚有三大问题需要梳理。
2018年2月份已批准通过仿制药质量和疗效一致性评价品种目录(第二批)
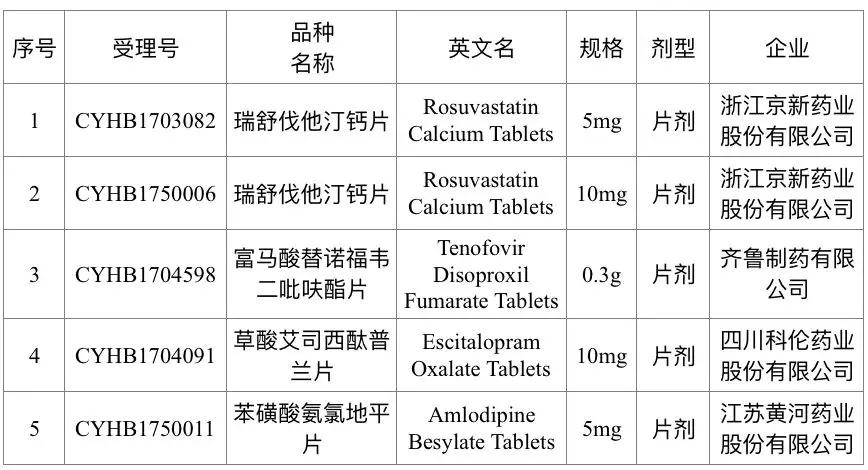
注:仅苯磺酸氨氯地平片为289目录品种
问题1 原研地产化要不要做BE?
从仿制药参比制剂目录(第十一批)起,CFDA开始公布被列入参比制剂的原研地产化产品名单,到2018年2月14日为止共46个原研地产化产品正式作为参比制剂。其中吲达帕胺缓释片、盐酸氟桂利嗪胶囊、阿卡波糖片、苯磺酸氨氯地平片、缬沙坦胶囊、多潘立酮片、酒石酸美托洛尔片、克拉霉素片、利培酮尼莫地平片、盐酸特拉唑嗪片、左氧氟沙星片、阿立哌唑片、多巴丝肼片、格列美脲片、氯雷他定片和蒙脱石散18个产品都是289目录的产品。原研地产化产品列入参比制剂将方便仿制药生产厂家,后者无需再去海外采购原研药。
表1:46个原研地产化参比制剂
|
目录名称
|
药品通用名称
|
持证商
|
|
第十一批
|
阿卡波糖片
|
拜耳医药保健有限公司
|
|
奥美沙坦酯片
|
第一三共制药(上海)有限公司
|
|
苯磺酸氨氯地平片
|
辉瑞制药有限公司
|
|
多潘立酮片
|
西安杨森制药有限公司
|
|
伏格列波糖片
|
天津武田药品有限公司
|
|
甲钴胺片
|
卫材(中国)药业有限公司
|
|
酒石酸美托洛尔片
|
阿斯利康制药有限公司
|
|
坎地沙坦酯片
|
天津武田药品有限公司
|
|
克拉霉素片
|
上海雅培制药有限公司
|
|
利培酮片※
|
西安杨森制药有限公司
|
|
美洛昔康片
|
上海勃林格殷格翰药业有限公司
|
|
蒙脱石散
|
博福-益普生(天津)制药有限公司
|
|
尼莫地平片
|
拜耳医药保健有限公司
|
|
培哚普利叔丁胺片
|
施维雅(天津)制药有限公司
|
|
头孢克洛胶囊
|
礼来苏州制药有限公司
|
|
盐酸贝那普利片
|
北京诺华制药有限公司
|
|
盐酸多奈哌齐片
|
卫材(中国)药业有限公司
|
|
盐酸氟桂利嗪胶囊
|
西安杨森制药有限公司
|
|
盐酸曲美他嗪片
|
施维雅(天津)制药有限公司
|
|
盐酸特拉唑嗪片
|
上海雅培制药有限公司
|
|
依卡倍特钠颗粒
|
天津田边制药有限公司
|
|
吲达帕胺缓释片
|
施维雅(天津)制药有限公司
|
|
左氧氟沙星片
|
第一三共制药(北京)有限公司
|
|
第十二批
|
阿立哌唑片
|
浙江大冢制药有限公司
|
|
阿托伐他汀钙片
|
辉瑞制药有限公司
|
|
艾司奥美拉唑镁肠溶片
|
阿斯利康制药有限公司
|
|
多巴丝肼片
|
上海罗氏制药有限公司
|
|
富马酸替诺福韦二吡呋酯片※
|
葛兰素史克(天津)有限公司
|
|
格列美脲片
|
赛诺菲(北京)制药有限公司
|
|
格列齐特缓释片
|
施维雅(天津)制药有限公司
|
|
枸橼酸西地那非片
|
辉瑞制药有限公司
|
|
卡培他滨片
|
上海罗氏制药有限公司
|
|
洛索洛芬钠片
|
第一三共制药(上海)有限公司
|
|
氯雷他定片
|
拜耳医药(上海)有限公司
|
|
培哚普利吲达帕胺片
|
施维雅(天津)制药有限公司
|
|
头孢克洛干混悬剂
|
礼来苏州制药有限公司
|
|
盐酸曲美他嗪缓释片
|
施维雅(天津)制药有限公司
|
|
第十三批
|
单硝酸异山梨酯缓释片
|
阿斯利康制药有限公司
|
|
氟伐他汀钠缓释片
|
北京诺华制药有限公司
|
|
兰索拉唑肠溶胶囊
|
天津武田药品有限公司
|
|
硫酸特布他林片
|
阿斯利康制药有限公司
|
|
赛洛多辛胶囊
|
第一三共制药(北京)有限公司
|
|
替比夫定片
|
北京诺华制药有限公司
|
|
托吡酯片
|
西安杨森制药有限公司
|
|
缬沙坦胶囊
|
北京诺华制药有限公司
|
|
伊曲康唑胶囊
|
西安杨森制药有限公司
|
(数据来源:咸达数据V3.5)
(注:“※”已有仿制药获得一致性评价称号)
原研药选择地产化,归根到底就是为了应对一致性评价政策所带来的仿制药竞争压力,仿制药和过期原研药同属一个质量层次竞争价格,过期原研药降价是必然趋势,原研地产化将降低原研药厂的生产成本,比如苯磺酸氨氯地平片、利培酮片和富马酸替诺福韦二吡呋酯片都已有仿制药过一致性评价。除了上述三个产品,蒙脱石散、阿托伐他汀钙片、格列美脲片、卡培他滨片、洛索洛芬钠片、氯雷他定片也已有仿制药申报一致性评价。
此前法规曾一度要求原研地产化也要完成生物等效性试验,辉瑞也在2017年12月公开了辉瑞大连生产的和美国生产苯磺酸氨氯地平片BE研究,但该产品在仿制药参比制剂目录(第十一批)中公示为原研地产参比制剂,辉瑞确认仿制药一致性评价BE试验已被批准豁免。鉴于试验尚未启动,辉瑞主动终止该试验。由此看来,生产工艺若不发生重大变更,原研地产化基本免做BE。
问题2:重复目录的289产品是否开展一致性评价?
一致性评价289目录的产品进入CFDA三批过度重复药品的产品共93个化学成分164个产品,占比57%。那么,这164个产品是否需要开展一致性评价呢?
一般而言,过度重复目录产品大多数为技术门槛较低的产品。但是,有8个产品比较特殊,既是289目录,又是三批过度重复药品,还属于289基药目录中的国内特有品种名单产品,分别是:复方甘草片、复方利血平氨苯蝶啶片、复方利血平片、复方氢氧化铝片、氢溴酸山莨菪碱片、消旋山莨菪碱片、鞣酸小檗碱片和盐酸小檗碱片。这8个产品需要与仿制药质量与疗效一致性评价办公室一起组织专家咨询会,解决评价方案中技术标准不确定的问题。预计此类产品愿意开展一致性评价的企业也不多,若能成功完成一致性评价的,预计是拥有较大市场潜力的产品。
如表2所示,共89个化学成分160个289目录产品在三批过度重复目录中,包括销售规模较大的氨氯地平、硝苯地平、二甲双胍、格列美脲、左氧氟沙星、克拉霉素、头孢呋辛、奥美拉唑、阿奇霉素、氯雷他定等。其中氨氯地平、二甲双胍、格列美脲、头孢呋辛、奥美拉唑和阿奇霉素,是目前一致性评价临床试验企业启动数较多的产品。其中氨氯地平和头孢呋辛已有企业获得一致性评价称号。
表2:过度重复目录中的289目录产品
|
目录
|
化学成分
|
|
三批重复目录都进入
|
阿莫西林、阿莫西林克拉维酸钾、阿奇霉素、阿司匹林、阿托品、阿昔洛韦、氨茶碱、氨氯地平、氨溴索、昂丹司琼、奥美拉唑、奥美拉唑钠、倍他司汀、苯海拉明、吡嗪酰胺、布洛芬、茶碱、地尔硫卓、地塞米松、对乙酰氨基酚、多潘立酮、多西环素、二甲双胍、法莫替丁、酚酞、呋喃妥因、呋塞米、氟桂利嗪、氟康唑、复方甘草、复方磺胺甲噁唑、复方利血平、复方氢氧化铝、格列吡嗪、格列美脲、枸橼酸铋钾、红霉素、琥乙红霉素、环丙沙星、甲硝唑、甲氧氯普胺、胶体果胶铋、卡马西平、卡托普利、克拉霉素、克林霉素、雷尼替丁、利巴韦林、利福平、氯苯那敏、氯丙嗪、氯化钾、氯雷他定、美托洛尔、蒙脱石、尼莫地平、尼群地平、诺氟沙星、喷托维林、泼尼松、葡萄糖酸钙、普罗帕酮、普萘洛尔、氢化可的松、氢氯噻嗪、山莨菪碱、双氯芬酸钠、双嘧达莫、碳酸氢钠、特拉唑嗪、替硝唑、头孢氨苄、头孢呋辛钠、头孢拉定、维生素B2、维生素B6、硝苯地平、硝酸异山梨、小檗碱、辛伐他汀、熊去氧胆酸、溴己新、叶酸、依那普利、乙胺丁醇、异丙嗪、异烟肼、吲达帕胺、左氧氟沙星
|
|
进入第二、三批重复目录
|
苯妥英钠、氯氮平、舒必利
|
|
仅进入第三批重复目录
|
硝酸甘油
|
(数据来源:咸达数据V3.5)
从企业目前启动一致性评价的数据来看,市场潜力较大且技术相对较成熟的产品,无论是否在过度重复目录内,都是国内仿制热点。这类产品未来有可能因为一致性评价获得的企业数较多,而市场价格偏低,从而导致企业能获得的市场规模有限。
问题3 市场规模小的产品是否可以只做商业批?
2018年2月,CDE发布关于公开征求《化学药品仿制药注册批生产规模的一般性要求》意见的通知。目前争论最大的是口服制剂的注册批究竟要做多少规模。
根据《化学药品仿制药注册批生产规模的一般性要求》,口服制剂的普通片剂/胶囊剂(如速释片剂或胶囊剂等)注册批三批均应至少达到拟定商业化生产规模的10%或100,000制剂单位,两者中选更多的。口服制剂的散剂/溶液剂/混悬剂/颗粒剂/糖浆剂则要求注册批三批均应至少达到拟定商业化生产规模的10%。口服制剂的缓控释片剂/胶囊注册批三批均应该至少达到10万个制剂单位,并且建议注册批生产规模与拟定商业化生产规模一致。
10万个制剂单位早在中国药典2015年版四部《药物制剂人体生物利用度和生物等效性试验指导原则(9011)》提到:“受试药品应来自一个不少于生产规模1/10的批次,或10万个单位,两者中选更多的,除非另外说明理由。2017年8月25日CFDA和CDE发布的《关于征求一致性评价BE研究用药品上市销售问题意见的通知(征求意见)》第二条也提到:“BE研究受试药品应不少于10万个制剂单位,鼓励企业采用商业化生产批药品进行BE研究。”
争论主要来自于市场潜力销量较少、年产量不足10万个制剂单位的产品,商业批的产量能否作为注册批的考量呢?
CFDA官网2015年5月6日发布的化学药品新注册分类申报资料要求(试行)(80号文)中也提到,“临床试验/BE试验样品的处方、工艺、生产线应与商业化生产一致”。
《仿制药质量和疗效一致性评价生产现场检查指导原则》要求“现场检查与所抽样品的生产批量应当与拟供应市场的商业化生产规模(批量)一致,并且与用于生物等效性研究、临床研究、体外评价的产品生产规模(批量)一致”。
参考FDA的1997年指南《Guide for Industry——TheFDA published Good Guidance Practices in February 1997》,对于市场规模很小的药品,鉴于仿制药相关的法规要求最低批量是10万制剂单位,且BE试验批理论上应和拟定的商业批量一致,生产企业若希望做小于10万制剂单位的商业批,并采用低于10万批量样品做BE试验,则需要和FDA仿制药办公室沟通确认。
如果CFDA硬性规定要按照10万制剂单位,那么一些罕见病的仿制热情会受限,就算法规认定供BE研究用商业化生产的研究药品在通过一致性评价后可上市销售,但是这类产品即便过效期了也难以卖完。
(信息来源:医药经济报)Top
总局办公厅关于实施《医疗器械网络销售监督管理办法》有关事项的通知(食药监办械监〔2018〕31号),2月27日公布。主要内容如下:
《医疗器械网络销售监督管理办法》(国家食品药品监督管理总局令第38号)(以下简称《办法》)已发布,自2018年3月1日起施行。为贯彻落实《办法》的有关要求,现将有关事项通知如下:
一、大力做好《办法》宣传贯彻和培训工作
各级食品药品监督管理部门要高度重视,认真宣传贯彻落实《办法》,专门制定宣传贯彻培训计划,切实做好宣传贯彻培训工作。总局已于2018年1月对省级食品药品监督管理部门等开展了培训,省级食品药品监督管理部门要加强对市、县级食品药品监督管理部门及企业的培训和相关工作的指导。
二、切实做好医疗器械网络销售监督管理工作
(一)各级食品药品监督管理部门要切实做好医疗器械网络销售监督管理工作,《办法》施行后,要加强对行政区域内从事医疗器械网络销售的企业和医疗器械网络交易服务第三方平台提供者的监督管理,督促企业和医疗器械网络交易服务第三方平台提供者切实履行主体责任。
(二)省级食品药品监督管理部门要按照《办法》等规定要求,切实做好医疗器械网络销售和交易监测信息的处置工作,指定专人负责国家医疗器械网络交易监测平台信息接收、调查处理结果上传等相关工作,并于2018年2月28日前将医疗器械网络交易监测平台注册申请表报送总局器械监管司。
三、关于医疗器械网络销售和医疗器械网络交易服务第三方平台备案工作
(一)总局在“医疗器械生产经营许可备案信息系统”(以下简称“信息系统”)中增加了医疗器械网络销售和医疗器械网络交易服务第三方平台备案等功能,将于2018年3月1日起正式启用。办理医疗器械网络销售和医疗器械网络交易服务第三方平台备案、变更等业务时,相关监管人员和企业有关人员可从国家食品药品监督管理总局网站首页(http://www.sfda.gov.cn/WS01/CL0001/)“网上办事”栏目中的“医疗器械生产经营许可备案信息系统”点击进入。
(二)从事医疗器械网络销售的企业可通过“信息系统”向所在地设区的市级食品药品监督管理部门办理备案并填报医疗器械网络销售信息表,设区的市级食品药品监督管理部门对填报的信息进行核实,符合规定的,应当于7个工作日内向社会公开备案信息。
(三)医疗器械网络交易服务第三方平台提供者可通过“信息系统”向所在地省级食品药品监督管理部门办理备案,填报医疗器械网络交易服务第三方平台备案表并提交相关材料,省级食品药品监督管理部门应当当场对企业提交材料的完整性进行核对,符合规定的予以备案,发给医疗器械网络交易服务第三方平台备案凭证并在备案后7个工作日内向社会公开相关备案信息。
(信息来源:国家食品药品监督管理总局)Top
总局关于发布抗抑郁药的药物临床试验技术指导原则的通告(2018年第39号),2月27日公布。
《抗抑郁药的药物临床试验技术指导原则》原文请见:
http://www.sda.gov.cn/WS01/CL0050/225542.html
(信息来源:国家食品药品监督管理总局)Top
科技部 财政部关于印发《国家科技资源共享服务平台管理办法》的通知(国科发基〔2018〕48号),2月24日公布。
国家平台的主要任务包括:
1.围绕国家战略需求持续开展重要科技资源的收集、整理、保存工作;
2.承接科技计划项目实施所形成的科技资源的汇交、整理和保存任务;
3.开展科技资源的社会共享,面向各类科技创新活动提供公共服务,开展科学普及,根据创新需求整合资源开展定制服务;
4.建设和维护在线服务系统,开展科技资源管理与共享服务应用技术研究;
5.开展资源国际交流合作,参加相关国际学术组织,维护国家利益与安全。
(信息来源:科技部)Top
国家中医药管理局政策法规与监督司关于印发《中医药监督工作指南(测试版)》试点工作方案的通知,2月24日公布。《中医药监督工作指南(测试版)》试点工作方案中部分内容如下:
目标任务:
1.检验《中医药监督工作指南(测试版)》(以下简称《指南》)的科学性、规范性、指导性,汲取好的经验和做法,进一步修改完善《指南》,为今后在全国范围推行《指南》奠定良好基础。
2.加快推进中医药监督执法工作发展,明确中医药监督执法职责和任务,建立健全工作制度,提升监督执法能力。
3.完善中医药监督执法基础理论,加强中医药监督执法的规范化建设,发挥示范引导作用。
试点地区:
天津、辽宁、江苏、海南、四川、甘肃等6省市。
试点内容
(一)各省(市)明确试点监督机构和联系人。
(二)组织开展《指南》试点方案的学习、培训工作。
(三)开展试点工作,及时收集在指南试用过程中遇到的问题。
(四)定期组织召开试点工作研究及推进会议,并进行督导调研。
(五)试点工作结束后按时上报试点工作总结及相关材料。
(信息来源:国家中医药管理局)Top
工业和信息化部关于公布第八批国家新型工业化产业示范基地名单的通知(工信部规〔2018〕36号),2月24日公布:同意上海金山工业园区等15个产业集聚区为“国家新型工业化产业示范基地(优势类)”、天津滨海高新区华苑产业区等36个产业集聚区为“国家新型工业化产业示范基地(特色类)”。
《通知》中:同意上海金山工业园区等15个产业集聚区为“国家新型工业化产业示范基地(优势类)”、天津滨海高新区华苑产业区等36个产业集聚区为“国家新型工业化产业示范基地(特色类)”。
《第八批国家新型工业化产业示范基地名单》中医药相关内容是:
|
序号
|
上报单位
|
国家示范基地名称
|
类别
|
|
15
|
江苏省经信委
|
医药·江苏连云港经济技术开发区
|
优势
|
|
30
|
山东省经信委
|
医疗器械·山东威海火炬高技术产业开发区
|
优势
|
|
48
|
甘肃省工信委
|
生物医药·兰州高新技术产业开发区
|
特色
|
(信息来源:工信部)Top
《总局关于对医疗机构应用传统工艺配制中药制剂实施备案管理的公告(2018年第19号)》2月12日发布。主要内容如下:
一、本公告所规定的传统中药制剂包括:
(一)由中药饮片经粉碎或仅经水或油提取制成的固体(丸剂、散剂、丹剂、锭剂等)、半固体(膏滋、膏药等)和液体(汤剂等)传统剂型;
(二)由中药饮片经水提取制成的颗粒剂以及由中药饮片经粉碎后制成的胶囊剂;
(三)由中药饮片用传统方法提取制成的酒剂、酊剂。
三、医疗机构所备案的传统中药制剂应与其《医疗机构执业许可证》所载明的诊疗范围一致。属于下列情形之一的,不得备案:
(一)《医疗机构制剂注册管理办法(试行)》中规定的不得作为医疗机构制剂申报的情形;
(二)与市场上已有供应品种相同处方的不同剂型品种;
(三)中药配方颗粒;
(四)其他不符合国家有关规定的制剂。
四、医疗机构配制传统中药制剂应当取得《医疗机构制剂许可证》,未取得《医疗机构制剂许可证》或者《医疗机构制剂许可证》无相应制剂剂型的医疗机构可委托符合条件的单位配制,但须同时向委托方所在地省级食品药品监督管理部门备案。
(信息来源:国家食品药品监督管理总局)Top
《总局关于批准发布YY 0285.5—2018《血管内导管 一次性使用无菌导管 第5部分:套针外周导管》等16项医疗器械行业标准的公告(2018年第27号)》2月28日发布。主要内容如下:
YY 0285.5—2018《血管内导管一次性使用无菌导管 第5部分:套针外周导管》等16项医疗器械行业标准已经审定通过,现予以公布。标准自2019年3月1日起实施。
(信息来源:国家食品药品监督管理总局)Top
CFDA《中药保护品种公告(延长保护期第11号)(2018年第25号)》,2月24日公布。
根据《中药品种保护条例》第十六条及有关规定,经国家中药品种保护审评委员会组织的委员审评、国家食品药品监督管理总局核准,对以下5家企业生产的5个中药保护品种继续给予保护:

(信息来源:国家食品药品监督管理总局)Top
CFDA《中药保护品种公告(延长保护期第11号)(2018年第25号)》,2月24日公布。
根据《中药品种保护条例》的规定,国家食品药品监督管理总局批准以下5家企业生产的5个中药品种列为首家中药保护品种:
|
序号
|
药品名称
|
保护级别
|
保护期限
|
保护品种号
|
生产企业
|
|
1
|
龙香平喘胶囊
|
2
|
2018年2月24日—2025年2月24日
|
ZYB2072017011
|
山东华信制药集团股份有限公司
|
|
2
|
金天格胶囊
|
2
|
2018年2月24日—2025年2月24日
|
ZYB2072017012
|
金花企业(集团)股份有限公司西安金花制药厂
|
|
3
|
四磨汤口服液
|
2
|
2018年2月24日—2025年2月24日
|
ZYB2072017013
|
湖南汉森制药股份有限公司
|
|
4
|
灯盏花素滴丸
|
2
|
2018年2月24日—2025年2月24日
|
ZYB2072018002
|
南昌弘益药业有限公司
|
|
5
|
骨参片
|
2
|
2018年2月24日—2025年2月24日
|
ZYB2072018005
|
武汉科兴医药科技开发有限公司
|
(信息来源:国家食品药品监督管理总局)Top
目前,整个医药流通行业集中度较低,市场竞争激烈,减少流通企业数量,加快行业整合,提高行业集中度成为医药流通行业发展及相关医改政策的一个基本方向。
■百强药批将占9成市场
根据国家食品药品监督管理总局统计,截至2016年11月底,全国共有药品批发企业12975家;药品零售连锁企业5609家,下辖门店220703家;零售单体药店226331家,零售药店门店总数447034家。
过去五年,国内药品批发企业集中度持续提高。前100位药品批发企业主营业务收入占同期全国市场总规模的比重持续上升,过去5年年均增长1.38个百分点。
根据商务部发布的运行统计报告,2016年药品批发企业主营业务收入前100位占同期全国医药市场总规模的70.9%;其中,四家全国龙头企业主营业务收入占同期全国医药市场总规模的37.4%。2016年药品批发企业主营业务收入前100位同比增长14.0%;其中,四家全国龙头企业主营业务收入同比增长12.2%。
根据商务部2016年12月发布的《全国药品流通行业发展规划(2016~2020年)》(以下简称“《规划》”),其中明确提出,到2020年,药品批发百强企业年销售额占药品批发市场总额90%以上,加上目前各项医改政策的逐步落实,药品批发行业整合进一步加快。
医药批发企业按照业务区域可以划分为全国性和区域性医药批发企业(部分企业带有医药零售业务)。目前,全国有四家全国性医药批发企业龙头,各个地区又存在一家或者多家区域性龙头企业。
■四大龙头药批实力分析
中国医药集团总公司,依托其子公司国药控股股份有限公司拥有全国最大的药品分销网络,主要销售包括药品、医疗器械和药材饮片等,销售规模连续数年在全国医药流通企业排名中位居第一。
华润医药控股有限公司,依托其子公司华润医药商业集团有限公司作为医药流通的经营主体,在全国30个重点省市建立了销售网络,在2016年度医药批发企业主营业务收入排名第二。
上海医药集团股份有限公司,在2016年度医药批发企业主营业务收入排名第三,覆盖全国20个重点省市,主要集中在华东、华北和华南区域。
九州通医药集团股份有限公司,作为中国最大的民营医药流通企业,其营销网络已经覆盖国内70%以上的行政区域,并与超过10万家下游客户建立了稳定的业务关系。
上述4家公司均为集团公司,业务板块以医药批发业务为主。2016年医药流通板块毛利率基本维持在6.33~7.57%,整体营业利润率受其他高毛利板块的影响维持在较高水平(7.63~15.31%)。
九州通是目前中国最大的民营医药流通企业,拥有较为独特的快批模式——主要供应第三终端等基层医疗市场,业务专注于医药流通,因此与三大巨头相比收入规模较小,由于九州通医药工业板块收入占比小且毛利率相对较低,使得其整体营业利润率低于其他3家(为7.63%)。
作为医药流通企业的核心竞争力之一,营销网络的建设和物流配送能力不仅影响目前行业的竞争格局,在行业加速整合阶段,庞大且高效的营销网络和物流配套将是决定医药流通企业未来行业地位的决定因素之一。
中国医药集团的营销网络按照全国及省级两级集中采购体系建设。截至2016年底,中国医药集团在北京、上海、广州及西安建立了4个枢纽,省级物流中心38个,地市级物流网点185个,零售物流网点24个,总网点251个。
物流中心拥有先进的仓储条件,运用现代化的信息管理系统对各个区域的药品进行统一调配。
此外,中国医药集团还会为供应商及客户提供包括供应商解决方案、网上产品订购、存货追踪与管理、分销中心管理及供应链管理顾问服务等供应链增值服务。截至2017年3月底,中国医药集团直销客户已覆盖全国15589家医院,此外还拥有其他分销商客户8911家及零售药店90122家。
华润医药控股旗下医药流通经营主体华润医药商业集团是北京市最大的医药流通企业,拥有7.7万平方米经营场所,北京地区有9万平方米医药物流配送中心。
华润医药商业集团承担了包括北京14个区县的基药配送,还承担了山东、辽宁、吉林、黑龙江、河南、江苏等区域共计150个地级市和县级市的社区、新农合配送。
上海医药已形成以华东、华北、华南三大区域为核心的全国性分销网络,覆盖20个省市及自治区及各类医疗机构超过2.5万家,医药零售分布在16个省市区,总数达1800多家。
2016年上海医药完成固定资产投资10.98亿元,主要用于GMP改造及医药物流建设,在完善北京、上海等全国物流基地建设的同时,积极推进华东、华中和华南区域物流中心的建设,是全国首家国家级医药物流服务业标准化企业。
九州通先后在湖北、北京、河南、上海、广东、福建、江苏等地投资设立30家省级医药物流中心和54家地市级物流中心,截至2016年底,九州通已经布局了84个医药物流配送中心,拥有零售药店911家(含加盟店)。
■行业基本格局——4+N
区域性医药流通(以医药批发为主)公司包括嘉事堂药业股份有限公司和国药集团药业股份有限公司、山东省的瑞康医药股份有限公司、江苏省的南京医药股份有限公司、广东省的广州医药有限公司和国药集团一致药业股份有限公司等。
目前随着新医改政策的推进及行业竞争压力加大,区域性的医药流通企业开始纷纷整合当地医药流通资源,加大渠道下沉力度,巩固自身竞争力。
总体看,随着新医改政策的不断推进,行业内兼并重组现象将成为常态,目前全国已经形成四家全国性龙头和多家区域性龙头企业为格局的行业生态。
由于前四家在规模体量、营销网络建设、上游药品和下游客户资源的控制力度上与其他区域性龙头企业有绝对性差距,区域性龙头短期内很难赶超四家全国性龙头企业,未来“4+N”模式将成为行业基本格局。
(信息来源:联合研究报告)Top
随着新医改的全面推行,在CFDA监管趋严、医院控费、医保支付改革、两票制落地等各种大招齐放之下,有不少人认为,“医药商业的日子,越来越不好过了”。
弱弱的问一句:是现在太难,还是过去太容易?2018年,医药商业会变得更加难做吗?
■或许不会更难
据海通证券分析,2017年A股医药商业公司已经在业绩上反映了零加成、两票制及招标降价带来的负面影响,预计2018年下半年出现拐点。
1、两票制使行业加速集中
截至2018年1月,两票制已经在全国24个省份执行,大陆其余7个省份均处于过渡期,海通证券预计,2018年底,大陆31个省份将全面执行两票制。
在过渡期小型流通企业去库存,同时小型流通企业原有品种仍然向医院销售,导致大型流通企业调拨减少同时纯销业务没有加速增加。因此,两票制初期,对大型流通企业的影响均为负面影响。
两票制正式执行后,小型流通企业部分药品退出医院,大型流通企业趁机填补空白,流通行业集中度有望加速提升。
2、零加成的负面影响逐步消除
截至2017年底,大陆31个省份已全部完成公立医院零加成改革,零加成对行业影响大部分集中在响逐步消除,药品流通行业将逐渐恢复正常增长。
海通证券认为,零加成导致医院开药动机减少,伴随药占比控制与辅助用药限制,医院开药量或开药金额增速会有短暂下滑,但随着医疗需求的持续增长,后续药品增速将恢复正常增长。
3、招标的影响逐渐减小
2015年国务院7号文和卫计委70号文要求各省市2015年开启新一轮招标,截至2017年底,27个省份已经执行新标。
经过2015年新一轮招标杀价,未来仿制药招标降价幅度有望放缓,同时,医保支付价改革和一致性评价有望促使高品质仿制药市占率提升,低品质仿制药逐渐退出市场,有利于同类药品平均价格恢复正常水平,未来招标对流通行业影响将越来越小。
■或许会更难
近两年,被称为医药商业“关键之年”。想想,有多少个地方的医药商业因为资金链问题、税票问题、利润问题导致停业整顿的、被兼并的,或者直接不玩了……
据统计,全国1.19万家商业,仅仅2017年就消失了1050多家。有专家预测,在未来一段时间之内,还有50%甚至更多的商业将会消失。
如今,“营改增”“两票制”已经落地,医药流通行业环境的重构已成事实,大洗牌正在进行。
在以前,很多医药商业分销产品不加价甚至有的还倒挂出手,多是因为下游很多终端因为管理不规范而不需要“票”,而很多的药品代理商对“票”的需求较为旺盛。
所以,对于医药商业而言,卖药赚不赚钱已不重要,“票”赚钱就行,加上流通企业多有“款期”,又可以支付承兑汇票,所以即使再小的商业公司,也可以避免资金的烦恼。
现在,有关部门对下游终端的监管更加严格,商业票据管理力度也更严格,代理过票的个体户越来越少,最终导致这条“利益链”的枯竭。未来,剩下的医药商业可能会因为以下价值而存在——终端配送职能、商业结款职能。
此外,医药行业是块“肥肉”,很多行外的巨头都紧紧盯着呢!
在医药流通领域,顺丰、EMS等第三方物流巨头已经杀进来了,未来还会更多的第三方物流加入,而他们在网络分布和物流能力上又占有很大的优势,远非传统医药物流能比,这也将对医药流通市场带来十分巨大的冲击。
虽然,现在的医药行业是不如以前好玩了,但是,在我们没有更多选择的情况下,静下心来,主动适应和改变才是王道。跟上主旋律的,依然是医药行业的佼佼者!
(信息来源:赛柏蓝)Top
2月26日,云南鸿翔一心堂药业(集团)股份有限公司发布2017年度业绩快报。业绩快报指出,2017年度一心堂实现营业总收入7,751,139,413.84元,同比增长24.03%;利润总额高达490,110,001.61元,同比增长19.72%;归属于上市公司股东的净利润为400,753,399.10元,同比增长13.41%。
(信息来源:21世纪药店)Top
2月26日,重庆智飞生物制品股份有限公司发布2017年度业绩快报,公司2017年营收为13.43亿元,同比增长201%;净利为4.32亿元,同比增长1229%。归属于上市公司股东的每股净资产1.84元,同比增长16.46%。
对于业绩上升幅度较大的原因,公告内容显示:报告期内,由于2016年“3.18疫苗行业事件”引发的行业政策变化等不确定性因素正逐渐消除,行业新政已逐步落地实施,行业环境得到进一步规范与净化,公司自主产品及代理的二类疫苗产品推广及销售等工作陆续恢复。
(信息来源:新浪医药)Top
总局关于批准注册88个医疗器械产品公告(2018年第24号)2月27日发布。
2018年1月,国家食品药品监督管理总局共批准注册医疗器械产品88个。其中,境内第三类医疗器械产品37个,进口第三类医疗器械产品20个,进口第二类医疗器械产品31个。
(信息来源:国家食品药品监督管理总局)Top
百济神州是一家处于商业化阶段的生物医药公司,专注于用于癌症治疗的创新型分子靶向和免疫肿瘤药物的开发和商业化。公司近日宣布瑞复美®(来那度胺)获得中国食品药品监督管理局(CFDA)批准与地塞米松合用,治疗此前未经治疗且不适合接受移植的多发性骨髓瘤(MM)成年患者。瑞复美是一种口服免疫调节药物,于2013年首次在中国获得CFDA批准与地塞米松合用,治疗曾接受过至少一种疗法的MM的成年患者。百济神州获得新基公司(Celgene)授予的独家经销,可在中国独家销售该药品。
(信息来源:美通社)Top
Top
2月26日,礼来制药称,美国FDA已批准abemaciclib联合芳香化酶抑制剂作为治疗绝经后激素受体阳性、人表皮生长因子受体2-阴性晚期或转移性乳腺癌女性患者的初始内分泌疗法。
(信息来源:新浪医药)Top
2月26日,北京世贸天阶生物科技股份有限公司发布公告称,公司自主研发的生物溶栓新药“注射用重组人组织型纤溶酶原激活剂改构体(rhM-tPA)”,商品名:宜真通,经国家药典委员会批准,核定通用名为“注射用替奈普酶”。公司于2018年1月18日向国家食品药品监督管理总局提交了“注射用替奈普酶”的新药上市申请,并于2018年2月23日正式拿到受理通知书。
(信息来源:新浪医药)Top
罕见慢性进行性肌肉骨骼疾病有新药,日本药企协和麒麟和Ultragenyx合作的单抗Burosumab最近获得欧盟的有条件批准。
这是治疗X连锁低磷血症(XLH)的第一个获得批准的新药。
Burosumab可以解决XLH中的纤维细胞生长因子23(FGF23)的活性,获批用于1岁以及1岁以上的儿童使用。这个单抗的上市名称为Crysvita。
(信息来源:健点子ihealth)Top
KemPharm近日宣布,美国FDA批准其Apadaz™的新药申请(NDA)。Apadaz™适用于治疗短期(不超过14天)急性重度疼痛(需要用阿片类止痛药并且没有适当的替代疗法)。Apadaz是KemPharm的前体药物benzhydrocodone和对乙酰氨基酚(acetaminophen,APAP)的立即释放(IR)组合,是FDA批准的首款Hydrocodone/Acetaminophen的前体药物。
(信息来源:药明康德)Top
总部位于瑞士的ObsEva SA,是一家临床阶段的生物制药公司,专注于15至49岁之间患有生殖健康和怀孕障碍的妇女的新疗法的开发和商业化。2月27日,公司宣布,其提高体外受精过程妊娠率的新药“nolasiban”Ⅲ期临床试验取得了积极的顶线成果。
(信息来源:生物探索)Top
近期,一项关于pimavanserin治疗阿兹海默病患者精神病症状的双盲、单中心2期临床试验的结果发表在3月份的《Lancet Neurology》杂志上,该研究由英国埃克塞特大学医学院(University of Exeter Medical School)的Clive Ballard博士领导。
Pimavanserin是一种选择性血清素反向激动剂(SSIA),能优先靶向5-HT2A受体,这些受体在失智症相关的精神病中发挥着重要作用。目前,Pimavanserin正在广泛的临床项目中进行评估,涉及多种适应症。2016年,FDA批准Pimavanserin(NUPLAZID®)用于治疗与帕金森病有关的幻觉和妄想,是首个用于该适应症的药物。
这项研究的结果在去年举行的阿兹海默病临床试验(CTAD)会议上公布。结果显示,在第6周时,治疗组的NPI-NH评分下降39.5%,明显高于安慰剂组的19.3%,达到了研究的主要终点。而且,没有观察到pimavanserin对患者的认知产生损害。
(信息来源:药明康德)Top
2月22日,苏州迈博斯生物宣布FDA批准了其人源化PD-L1单克隆抗体MSB2311用于治疗局部晚期或转移性实体肿瘤的临床试验申请。迈博斯生物已开始启动MSB2311的首次进入人体,开放性、多中心、剂量递增和扩展性临床研究。MSB2311是迈博斯生物第一个进入临床开发阶段的生物大分子。据称,和FDA已批准的PD-L1抗体相比,MSB2311不但具有独特的抗原结合表位,而且与抗原PD-L1的结合有独特的pH依赖性,有助于MSB2311抗体在肿瘤组织中回收,渗透,和富集。
(信息来源:药明康德)Top
Kadmon公司近日宣布了一项正在进行中的2期临床试验的顶线结果,这项研究旨在评估该公司的ROCK2(Rho-associated coiled-coil kinase 2)激酶抑制剂KD025在特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)患者中的疗效和安全性。这些IPF患者之前使用过(或被提供过)吡非尼酮(pirfenidone)和/或nintedanib治疗。数据显示KD025的耐受性良好,并表现出临床益处,在第24周时患者的用力肺活量(FVC)的平均下降量为48毫升,而接受最佳支持治疗(BSC)患者的平均下降量为175毫升,绝对差值为127毫升,相对差异为73%。
(信息来源:药明康德)Top
Mesoblast公司近日宣布,治疗类固醇难治性急性移植物抗宿主病(aGVHD)患儿的异基因间充质干细胞候选产品MSC-100-IV(remestemcel-L)的3期临床试验在第28天的总缓解率(ORR,完全缓解+部分缓解)成功达到主要临床终点。
(信息来源:药明康德)Top
2月26日,烟台正海生物科技股份有限公司发布关于组织再生膜临床试验进展公告称,因试验方案的预期目的与临床需求和效果有所偏离,决定终止“组织再生膜”项目。
(信息来源:新浪医药)Top
近日,中国政府网微信公众号推送了《这个小小的“+”号,国务院为何紧盯不放》一文,再一次提醒着我们,互联网+创业创新、+先进制造、+医疗、+食品药品监管……“各行业都在与互联网深度融合。”“互联网+”已成为经济社会创新发展的重要驱动力量,医药流通也不例外。
“互联网+医药流通”并不仅仅是简单的技术上的变革,也不能理解为利用互联网技术简单去替代人力,而是通过将互联网与医药流通领域的深度融合,以实现药品流通模式的转型升级。利用互联网和信息化技术,将外部需求信息与内部物流操作相结合,使企业在药品批发、物流配送、医药电商等方面实现高效率操作,促进产业升格。
“互联网+医药物流”,则使传统医药企业能够运用互联网技术进行数据收集、存储、分析及云计算等,从而拓宽流通路径,实现高效率整合。互联网医药平台,通过实现上游医药企业生产厂商、供应商与下游采购商进行信息的无缝对接,将线下的药品环节搬到线上,减少流通环节,降低成本。
■“互联网+”下的医药物流局势
“互联网+医药物流”体现在互联网技术支撑起了大数据的物流指挥系统,尤其是随着手持终端设备的普及,以移动互联网运用为代表的APP使物流业务变得更加便捷、实时,无论国内外,互联网电商的发展都会对医药物流价值链带来长足的影响:
一是促进第三方物流崛起。消费者购药的特性包含了量小以及分散等因素,物流成本容易抬高。对于实力较弱的医药企业而言,选择第三方物流或众包是最好的办法。新政允许企业委托第三方物流配送药物,物流企业可趁势构建医药物流系统,达到GSP体系要求,与医药电商供应链相连接,促进第三方物流的崛起。
二是电商物流将有望为物流价值链带来创新,推动信息化、标准化、自动化、流程化。
国务院办公厅印发《关于进一步改革完善药品生产流通使用政策的若干意见》中,鼓励整合药品仓储和运输资源,实现多仓协同,支持药品流通企业跨区域配送,加快形成以大型骨干企业为主体、中小型企业为补充的城乡药品流通网络。同时,“两票制”的实施将大幅压缩药品流通环节,加速药品零售、物流、电商行业的集约化、信息化、标准化进程。梳理发现,2017年国家出台涉及医药电商的重要政策法规或通知不少,其中最重磅、对未来医药电商发展影响最大的当属医药电商“三证”的取消,准入门降低,推动医药物流井喷。当然,虽然审批取消了、门槛降低了,监管也更加严格了。
众所周知,刚刚过去的2017年是严查年,不少药商挺过去了,但在互联网经济冲击下,中小药商是否还能屹立不倒是个未知数。阿里巴巴、京东商城、天猫医药馆、1号店、顺丰等跨界互联网企业份分红渗透到医药分销及物流行业,医药物流行业的转型升级将发挥更高效的作用。
京东官方数据显示,截至2017年6月,京东物流已覆盖全国2691个区县,自营配送覆盖了99%的人口。52%的订单6小时送达,92%的订单当日达或次日达。与此同时,京东物流于2017年下半年推出“医药云仓”项目,旨在为合作方提供整套系统化的医药供应链解决方案,涵盖了仓储、运输、配送等各环节。这个项目通俗来说就是药品生产企业将产品提前放入医药云仓,下游终端客户下单后,由京东负责物流配送。
■发展痛点仍存
“互联网+”虽然已经成为解决国内医药流通行业效率低下、成本等高弊端的利器,但一些新问题的出现也将影响流通局势。
1.物流与商流的不匹配。由于医药行业与其他传统行业相比较而言,其市场开放得相对较晚,加上医药物流数量、发展规模不足等问题的出现,都不同程度地为市场的发展拖了后腿。患者选择互联网购药时往往有较为紧迫的时间需求,部分OTC药品或医疗器械等因需要特殊包装处理、配送设施,对医药配送物流提出了更高要求。但不管是自营物流的医药生产企业还是专业化第三方医药流通企业,其在配送过程中如何确保产品品质,尚未得到满意解决。
2.标准体系建设滞后。首先是医药物流标准覆盖率低,某些方面存在真空地带,一些医药物流活动还无标准可依;其次是物流标准不统一,缺乏行业通用标准;再次,由于企业规模不一,有相当一部分企业对标准化问题没有意识或认识不足,出于成本因素等的考虑,缺乏执行相关标准的自觉性。
3.医药流动渠道复杂。在电商、物联网和互联网的发展带动下,消费者的需求越来越个性化,医药物流订单将走向碎片化,及时、小批量、多批次等特征将愈发明显。我国医药产品供应链节点较多,流通环节与交易复杂。药品在流通环节上的监控也出现了一些新情况。如果售后服务问题不能及时解决,不仅浪费了大量的社会资源,最终还导致医药价格的虚高、“看病难”等社会问题,必须创新医药物流模式。
■破局之策
医药物流未来发展的主导方向将会是围绕“互联网+”而不断创新,并且“互联网+医药物流”的融合势必加快医药物流信息化建设,加速资源整合,降低医药物流运营成本,进而提升相关企业竞争能力。
1.变革终端配送模式。面对日益增长的配送到终端患者的需求,医药物流终端配送模式变革是必然。医药制造企业、医药流通企业通过自营或专业第三方医药物流的方式,逐步建立起多种配送到病患的终端配送体系(包括配送到门店、门店配送到家、直接配送到家、配送到集中取货点、取药箱等)。
在移动互联技术的推动下,终端配送体系可以同步研发用户体验度高的信息系统,即多功能终端APP应用(可包含药品签收、回单确认、异常药物回传、患者用药提醒、用药过程查询等多种功能组合)。
此外,如何解决终端配送最后一公里的问题是近几年探讨最多的。现在有快递直送,有社区的生鲜自提柜,有前置微仓、同城闪送,还有与连锁便利店合作等形式,都在探索。现在又看到了无人售货架,预计医药物流的终端配送竞争将全面打响。同时,政府在相关基础设施上也会加大投入,互联网的技术发展高度依托于网络基础设施,与物流业相关的服务业如金融业、保险业等的不断完善,将营造良好的物流环境。
2.开启互联网与医药物流全方位管控模式。医药物流行业应当在创新改革、平台整合、结盟合作、全诚信建设等方面着重发力。首先,国家层面严格进行药品管理,把控药品源头;其次,企业通过电子监管系统上传药品各类信息,使含有智能监管码药品出厂后的所有物流过程都处于系统监控之下,逐步建成“药品生产-药品流通-用户”的全程监管体系。在此需要强调的是,全面的药品追溯体系建设将为互联网医药销售长远而健康的发展奠定基础,并规范现有药品,有效防止假冒伪劣,也可在药品流通过程出现问题时及时发现问题环节,并及时采取措施明显提升医药物流行业的规模化、集约化。
3.推进标准化建设。加强对医药物流及其标准化的研究,为加快我国医药物流标准化步伐、推进医药物流标准化进程奠定理论基础。制订针对医药物流的基础性物流标准,如对于医药物流从业准入门槛、医药物流从业人员职业技能要求、药品物流服务规范、药品容器、包装、编码等基础性标准进行规范,明确从业人员素质、医药仓储、运输环节作业规范等。加强标准化的宣传和引导,提高企业对医药物流标准重要性的认识,鼓励企业、行业协会等从自身工作实际出发,提出符合实践要求的医药物流标准。最后,还要不忘注重专业人才队伍的培养与建设。
4.实践高效物流。移动互联网能够满足医院、医药企业等各方的物流需要,同时实现信息共享,提高物流运输的效率。医药物流需要和移动互联网进行结合,去掉一些中间环节,更直接地对信息进行传递。具体做法可以是灵活的,如医药物流企业开发出一种APP终端,使得医药企业、医院能够借助这个APP来实现物流下单的功能。也可以在这个APP软件中查找药品库存,对物流信息进行跟踪了解,以实现全品种全链条全程可视化、可追溯,最终实现渠道库存可视、物流过程实时监控、库存科学预测及决策、供应链高效协同等功能。
传统的医药流通领域存在诸多不足,“互联网+医药物流”普惠时代的到来尚需时日,相关企业还有很多方面需要改善。随着政策支持力度的不断加大、基础建设投入的增加、相关法律法规的完善,传统医药流通与互联网将会有更好的融合。引进先进的物流设备、信息技术,对物流渠道、物流系统进行必要的整合,实现物流信息的共享和对接,是新时代的召唤。只有这样,才能更好地降低医药运输的成本,提高物流效率,满足产业链各方需要。
(信息来源:医药经济报)Top
对于国内非小细胞肺癌市场而言,本就竞争激烈的三国杀局势,需要各出奇招的时候到了。对于阿斯利康中国的下一代当家花旦而言,泰瑞沙的顺利准入只是序幕,泰瑞沙在中国创下了新药上市的速度新纪录。
泰瑞沙在中国创下了新药上市的速度新纪录。
对于阿斯利康中国的下一代当家花旦而言,泰瑞沙的顺利准入只是序幕。对于国内非小细胞肺癌市场而言,本就竞争激烈的三国杀局势,需要各出奇招的时候到了。
3月24日,阿斯利康宣布国家食品药品监督管理局(CFDA)批准其三代肺癌靶向治疗药物泰瑞沙(甲磺酸奥西替尼片)在中国上市。这不仅是全球第一个上市的第三代口服、不可逆的选择性EGFR突变抑制剂,也是中国首个获批的用于EGFRT790M突变型阳性的局部晚期或转移性非小细胞肺癌药物,而它更是创下了2007年化药注册分类实施后进口药在中国上市的速度记录。
2015年底,CFDA发布《关于解决药品注册申请积压实行优先审评审批的意见(征求意见稿)》,开辟绿色通道,加快临床急需等药品的审评。对于泰瑞沙来说,从进入绿色通道到正式获批,只用了七个月的时间,而彼时距离其在美国获批也仅仅只有16个月。
■出乎预料
2015年底,CFDA出台药品优先审评审批政策,其初衷是解决药品注册申请积压中某些临床急需、市场短缺的药品注册申请排队的问题。
药品获批的速度对于药企的重要性不言而喻。对于企业来说,优先审评制度减少了新药排队等候的时间,提高了新药研发的效率,加快新药上市;对于行业来说,优先审评制度使有限的审评资源向创新和临床急需品种倾斜,行业品种青黄不接的局面会逐步得到缓解。
在今年两会期间的部长通道上,CFDA局长毕井泉在回应“部分国外药国内买不到”的问题时表示,这种现象确实存在,但原因是多方面的,例如制度设计、知识产权保护政策未落实、医保目录调整不及时以及药品审评效率等。
一直以来,由于审批流程冗长,一款创新药在中国上市至少要比世界其他国家滞后6年到8年甚至更久。而优先审评制度的建立不仅让一批创新药和临床急需药物快速上市,更让一批“全球新”药物获准进入临床。
截至目前,国家食品药品监督管理局药品审评中心(CDE)累计公示25批拟纳入优先审评审批药品,最终271个药品进入优先审评绿色通道。
“实际上我们在接到CFDA获批通知的时候,内部团队针对泰瑞沙的产品培训都还没有完成。”在泰瑞沙中国上市发布会上,阿斯利康中国副总裁、肿瘤业务部负责人梁怡坦言,泰瑞沙获批速度之快完全出乎了他们的预料。
泰瑞沙在中国的获批上市,距离其正式提交注册申请不过两年半左右的时间,距离其正式提交上市申请不到两个月,比2015年11月获得美国FDA批准也只晚了6个月左右。梁怡透露,泰瑞沙中国上市时间规划表甚至贴在了全球CEO的桌子上,由此可见阿斯利康对于泰瑞沙中国上市的高度重视。
作为全球第一个上市的第三代口服靶向药,泰瑞沙也是中国首个获批的用于T790M突变型阳性的局部晚期或转移性非小细胞肺癌的肿瘤药物,并且目前在中国没有同类产品。其以应答率数据获得FDA加速批准上市,首个Ⅲ期生存数据显示,泰瑞沙作为二线疗法,相比含铂类药物的二联标准化疗可使无进展生存期显著延长5.7个月,这也是其能够在美国和国内均能进入快速审评通道的原因所在。
阿斯利康中国副总裁、企业事务与市场准入负责人黄彬认为,通过泰瑞沙的获批看到了整个药审体系的高效运转,以后也可能会有其他品种的快速获批。但另一方面,客观条件的限制比如人力不足,也决定了这样的高效成果很难复制到所有品种。
■三国杀
根据数据统计,2015年我国用于肺癌市场的小分子靶向药物市场规模为32.3亿元,2010年~2015年复合增长率为22.6%。目前主要的三种产品埃克替尼(凯美纳)、吉非替尼(易瑞沙)和厄洛替尼(特罗凯)均适用于治疗接受过化疗或不适于化疗的局部晚期或转移性非小细胞肺癌。
泰瑞沙的上市,让阿斯利康较之其他竞争对手先行一步。根据数据统计,中国非小细胞肺癌患者人数约占肺癌病例总数的80%-85%,约三分之二的患者在服药1年左右会由于T790M突变产生耐药,而泰瑞沙是目前针对T790M耐药唯一的药物选择。
作为非小细胞肺癌市场上的本土选手,贝达药业的凯美纳在成功入围首批国家药价谈判品种后,通过降价54%在2016年实现营收10.35亿元,同比增长13.36%,销量同比增长31.46%,该产品也占到贝达药业总营收的99.98%。而在纳入2017年新版医保目录后,也将有利于未来凯美纳的市场销售。
另一家跨国药企罗氏,尽管落选了首批国家药价谈判品种,但特罗凯在今年成功入围第二轮国家药价谈判,降价幅度超过了50%。
此外,2017年3月,勃林格殷格翰宣布,全球首个以及目前唯一上市的第二代、不可逆TKI类(酪氨酸激酶抑制剂)靶向药物阿法替尼将正式登陆中国市场。阿法替尼目前已在70多个国家被批准用于治疗EGFR突变阳性非小细胞肺癌患者,并在多个国家成为了EGFR靶向药物的首选。
易瑞沙从2005年在中国上市起,就一直是中国EGFR-TKI市场份额最高的药品。根据中金研报数据显示,2015年吉非替尼在中国销售额为12.43亿元,约占中国EGFR-TKI市场份额的38.5%。但随着本土企业和其他跨国药企的强势介入,阿斯利康仅凭借易瑞沙在国内非小细胞肺癌市场上前行将日趋困难。
而泰瑞沙的获批,在竞争日益激烈的当下给了阿斯利康一个重要武器。能够在这个节点上上市第三代产品泰瑞沙,从竞争力的角度来说,不仅能够捍卫住当下的市场份额,而且还有足够的实力向贝达和罗氏发起进攻。
另一个备受关注的问题就是价格。由于目前泰瑞沙还没有进入医院,因此购买途径主要来自药房。据了解,泰瑞沙的价格在每月5万元左右。而根据泰瑞沙慈善援助项目,城乡病前低保患者将免费获得药品援助直至疾病进展。而非低保患者可在使用泰瑞沙4个月后提出申请,获得批准后第一阶段最多可获得8个月的援助药品,此后在连续使用泰瑞沙3个月,符合条件的患者还可继续申请援助直至病情进展。
除了这些已经上市的产品外,近年来,随着肺癌发病率的不断增高,国内企业在该领域抗肿瘤药市场需求也在不断增加,并逐渐加大对抗肿瘤药领域的投入。
目前,国内至少有25家公司在申请吉非替尼的仿制,至少28家公司在申请厄洛替尼的仿制,而这其中不乏恒瑞医药、罗欣药业、先声药业等实力强悍的企业参与其中。2016年底,齐鲁制药研发的吉非替尼首仿药伊瑞可经CFDA批准取得上市许可持有人文号,成为中国首个药品上市许可持有人制度试点品种,并于2017年2月正式上市。最引人关注的是伊瑞可的上市直接使得原研产品易瑞莎的价格,从每盒5000多元直降到2000多元。
(信息来源:E药经理人)Top
纵观整个2017年,来自中国的制药企业共在美国斩获38个ANDA申请文号,其中包括31个正式文号、7个暂时性批准文号。在优先审评以及一致性评价等政策的引导之下,海外认证品种的国内价值正日益凸显。制剂国际化力量增厚的同时,ANDA的获批也在更大程度上为企业带来国内真金白银市场的话语争夺权。
相较于2016年8家中国制药企业在美国收获22个ANDA批件而言,2017年31个ANDA正式文号、7个暂时性批准文号的战果,似乎在彰显着中国制药军团进军国际市场的水平已又高一筹。
具体来看,2017年在美国取得ANDA正式批准文号的仍然是八家公司,按照获批数量由多至少,依次是华海普林斯通(8个)、江苏恒瑞(6个)、石药欧意(5个)、海正药业(4个)、人福药业(3个)、南通联亚(3个)、上海安必生(1个)、力品药业(1个)。
而取得暂时性批准文号的则涌现出一些新鲜面孔,如瑞阳制药的枸缘酸西地那非、海正宣泰的盐酸二甲双胍、华仁药业的缬沙坦氢氨噻嗪以及杨凌步长药业的他达拉非。
■华海药业:稳居榜首
在所有上榜企业中,一马当先的仍然是华海药业。作为国内首家通过FDA认证的制剂企业以及得到国际认证最多的制剂企业之一,华海药业近年来在制剂出口以及国际化发展领域俨然已经打出了自己的招牌形象。根据上市公司公告统计,自2007年以来,除2009年一年出现空档之外,每年华海药业都有相应的品种在美国获批,且数量近年来基本呈逐年增加的态势,2016年其共有6个品种获批,而2017年则达到历史最高,算上暂时性批准的两个产品,华海一共有10个产品在2017年获批ANDA。
而在所有这些产品中,最值得关注的是2017年8月获批的帕罗西汀胶囊,这是中国第一个专利挑战成功的品种。此前,华海子公司普林斯通与Actavis两家公司均就该产品对帕罗西汀胶囊的原研公司Noven提出了专利挑战,最终华海率先挑战成功。
要知道,这对于华海来说绝对是一件意义非凡的事情。想要成为一流仿制药企业,构建起一个架构完整的专利挑战体系与良好的专利诉讼体系是一件必须的事情,据悉,目前华海上百个仿制药项目至少涉及40个专利挑战项目,而一旦专利挑战成功,无疑就意味着抢占市场的能力进一步增强。帕罗西汀胶囊的成功获批就证明了这一点。
而另外一个值得关注的则是力品药业(厦门)获批的盐酸可乐定缓释片。这款药是由华海美国与力品药业共同投资、力品药业负责产品开发的品种。近年来,技术难度更高的缓释剂型已经成为了华海重点攻克的方向,目前从2013年至今也已有5个缓释剂型获批。
据西南证券测算,华海药业此次获批的11个品种(包括与力品药业共同开发的盐酸可乐定缓释片)于2016年在美国市场的销售总金额为92.28亿美元,如果按照平均10%的市占率测算,在美国的峰值销售将达到9.2亿元。如果按照出厂价为终端售价的20%、净利率为15%进行测算,则将预计给华海带来12.0亿元的收入增量预计1.8亿元的利润增量。
■恒瑞医药:厚积薄发
尽管相对于华海药业来说,恒瑞医药2017年6个ANDA似乎不足为道,但对于恒瑞医药自身而言,这绝对是一个爆发。要知道,自2011年恒瑞医药第一个ANDA盐酸伊立替康获批开始算起,到2017年之前,恒瑞医药也一共只有5个ANDA获得了批准。
仍然同此前的特点一样,此次获批的6个ANDA中,有5个都是注射剂,这跟恒瑞医药制剂国际化的战略有关,一直以来恒瑞都将视线集中在注射剂等工艺复杂、技术难度较高的领域,以及抗肿瘤、手术麻醉等市场容量极大的领域,此前获批的5个ADNA之中,也有3个都是注射剂。也正因此尽管数量相对较少,但几乎恒瑞医药获批的产品都是能带来大量利润的重磅产品。
而在国际化与创新并重的战略之下,国际市场也已经成为恒瑞越来越重要的发展动力之一。恒瑞此前便表示,将会加快推进海外市场,力争未来几年内使所有主力品种全部通过美国FDA或欧盟认证,为开拓海外市场打基础。
■石药欧意:跃升黑马
实际上,除了华海普林斯通之外,人福医药以及南通联亚的出现都不足为奇。已经顺利完成收购的美国仿制药Epic已经开始为人福医药贡献ANDA,而人福普克2017年也顺利拿下两个ANDA批文。南通联亚作为始终以欧美高端市场为主的非专利药研发和生产企业,近年来也是在美国FDA利好消息不断,尤其是去年在国内也有步长制药就硝苯地平控释片、盐酸二甲双胍控释片等5款药物达成了长期合作,其发展态势也可见一斑。
令人惊喜的是石药欧意在过去一年ANDA方面的表现。早在2016年,石药欧意就已经拿下了盐酸二甲双胍片的ANDA,而在CDE于2017年4月13日发布的第15批优先审评名单中,该药赫然在列,其被纳入优先审评的理由则为“同一生产线,已在美国上市,申请国内上市的仿制药”,而这时CDE首次以此理由将相关品种纳入优先审评名单。而在2017年,石药欧意则又拿下五个ANDA文号,其中包括硫酸氢氯吡格雷这样市场表现良好的品种,对于石药集团而言,这无疑是个好消息。
■海外制剂回归国内
尽管对于制药企业而言,能否通过FDA认证以及ANDA品种数量的多少,在很大程度上代表了企业的国际市场竞争力与影响力,但在如今的政策环境下,必须看到的一点是,海外认证品种的国内价值正日益凸显,石药集团盐酸二甲双胍片被纳入优先审评,就是一个典型的例子。
而这种政策环境,实际上主要还是两点,这也是在企业制剂国际化力量增厚的同时,国内市场不可忽视的两条路径:一是国内转报品种纳入优先审评,二是共线产品快速通过一致性评价。可以看到的是,目前国内政策对已在海外获批的高质量ANDA品种已提供了全方位的支持,从注册到招标到医保都提供了配套政策。
在注册申报层面,目前已经明确指出已在海外获批的ANDA产品可以简化一致性评价相关流程,如国内药品生产企业已在欧盟、美国和日本获准上市的仿制药,可以国外注册申报的相关资料为基础,按照化学药品新注册分类申报药品上市,批准上市后视同通过一致性评价;而在中国境内用同一生产线生产并在欧盟、美国和日本获准上市的,亦视同通过一致性评价。
这就意味着这些产品无需在国内做药学研究和BE试验,既能节约时间又能减少研发支出。一般而言,药学+BE需要一年时间,研发支出则在500万至800万元左右,如此一来制药企业便可以以更快的速度通过一致性评价,抢占国内市场。
仍然以华海药业为例,其申报的8个一致性评价产品于2017年6月7日或2017年7月31日获得注册受理,9月25日进入审评中心,7个产品于12月27日获批成为首批通过一致性评价的国内仿制药并进入中国上市药品目录集,从注册受理到获批仅6个月的时间,真正的审批时间仅3个月时间。此外还有6个ANDA产品转报国内生产的注册申请,已有5个品种进入优先审评。
而快速通过一致性评价则意味着产品在未来的市场招标中将得到巨大的优势。按照当下的政策,同品种药品通过一致性评价的生产企业达到3家以上的,卫生计生部门在药品集中采购等方面不再选用未通过一致性评价的品种。而一致性评价也已在多地被纳入原研竞价层次。
■ANDA那么多,NDA何时到来?
如果去翻看过去几年中国制药企业在美国获得的ANDA认证情况就不难发现,从2012年到2015年,对中国药企的ANDA的发证情况基本稳定,每年获批总数和涉及企业数量几乎完全相同。但从2016年开始,获批水平有了一个较为明显的提高,2017年更是如此。
这固然是一件好事,其意味着中国制药企业的制药水平已经日益得到全球主流市场的认可,中国药企在全球市场的竞争力也逐渐开始显现。但与此同时,在另外一个更能衡量制药水平与竞争力的指标上我们却一直没有突破:NDA,即新药申请。
最为人所熟知的,应当还是天士力的复方丹参滴丸,如果从1997年12月9日其正式通过美国FDA新药临床研究审评(IND)开始算起,其在美国的NDA之路已经走了超过二十年,而随着其三期临床试验结果的公布,复方丹参滴丸能否在美国最终完成NDA也成为了业界讨论的热点。
而另外一个被广为讨论的则是绿叶制药的505(b)(2)产品利培酮缓释微球肌肉注射制剂,此前其在美国已完成了一项由美国108名病人参与的关键性临床试验,并被美国FDA认为已足以支持其通过505(b)(2)途径在美递交新药申请,被视为接下来最有可能率先完成新药申请的中国企业之一。而最新的消息是,FDA已经豁免了绿叶作为新药申请方在提交NDA的申报资料时必须提交的儿科研究计划,这将大幅降低其药品的研发成本,加快上市的速度。
但尽管如此,到如今我们还尚未看到有任何一个产品NDA正式完成。不过,如今中国的医药产业中,创新药已经成为了一个大环境,国内自主创新药的质量再逐年提升,即便是以“全球新”这样一个维度来衡量,国内创新药产业也正处于一个爆发的前夜,如亚盛医药、恒瑞医药等多家公司目前均有产品在美国获批IND。
所以我们也不妨大胆畅想,2018年,我们很有可能迎来第一个在美国拿到NDA许可上市的中国自主创新药。到那时,中国制药在全球市场的底气注定将更足一些。
(信息来源:E药经理人)Top
2017年,CFDA共签发375个药品批文号,剔除医用氧、基础输液等批文,共有303个批文,163个药品。其中化药占94.4%,生物制品和中药占5.6%。国产药占59.4%,进口药占40.6%,国产和进口药批文数量接近。
随着我国一系列药品审评新政及优先审评等各项制度落地,进口药获批速度明显加快。这些进口新药治疗领域主要有:丙肝、肿瘤、糖尿病、帕金森病、艾滋病、高血压、抑郁症等。
现梳理2017年26个重点进口产品情况。据统计,这26个药品2016年全球销售额高达218亿美元,其中,6个丙肝治疗药物销售额为72.07亿美元,8个肿瘤药销售额为69.50亿美元,6个糖尿病药销售额为44.06亿美元,4个其他适应症药物销售额为32.49亿美元。
2017年有20多家外企的进口新药在国内上市,包括勃林格殷格翰、诺华、阿斯利康、艾伯维、百时美施贵宝、吉利德、强生、拜耳、罗氏、默沙东、诺和诺德、赛诺菲等。其中,勃林格殷格翰、诺华获批进口产品最多。进口新药大量获批以后,众多进口产品涌入中国市场,国内药品市场格局有望重构。
■抗肿瘤药
在肿瘤治疗领域,2017年批准上市的重点产品有:培唑帕尼片、马来酸阿法替尼片、维莫非尼片、磷酸芦可替尼片、瑞戈非尼片、甲磺酸奥希替尼片、注射用阿扎胞苷、伊布替尼胶囊,2016年这8个产品全球销售额为69.50亿美元。
品种:
培唑帕尼片:2017年2月,葛兰素史克公司肾细胞癌治疗药物培唑帕尼片获批进口,商品名为“维全特”,规格为200mg、400mg。2016年培唑帕尼全球销售额为7.29亿美元。
马来酸阿法替尼片:2017年2月,勃林格殷格翰肺癌治疗药物马来酸阿法替尼片获批进口,商品名为“吉泰瑞”,规格为20mg、30mg、40mg、50mg。2016年阿法替尼全球销售额为2.71亿美元。
维莫非尼片:2017年2月,罗氏黑色素瘤治疗药维莫非尼片获批进口,商品名“佐博伏”,规格为240mg。2016年维莫非尼全球销售额为2.2亿美元。
磷酸芦可替尼片:2017年3月,诺华治疗白血病的磷酸芦可替尼片获批进口,商品名“捷恪卫”,规格为5mg、15mg、20mg。2016年芦可替尼全球销售额为14.34亿美元。
磷酸瑞戈非尼片:2017年3月,拜耳胃肠间质瘤治疗药磷酸瑞戈非尼片获批进口,商品名“拜万戈”,规格为40mg。2016年瑞戈非尼全球销售额为3.04亿美元。
甲磺酸奥希替尼片:2017年3月,阿斯利康肺癌治疗药甲磺酸奥希替尼片获批进口,商品名“泰瑞沙”,剂型为片剂,规格为40mg、80mg。2016年奥希替尼全球销售额为4.23亿美元。
注射用阿扎胞苷:2017年4月,新基公司白血病治疗药注射用阿扎胞苷获批进口,商品名为“维达治”,剂型为粉针剂,规格为100mg。2016年该药全球销售额为7.38亿美元。
伊布替尼胶囊:2017年8月,艾伯维公司白血病治疗药伊布替尼胶囊获批进口,商品名“亿珂”,规格为140mg。2016年伊布替尼全球销售额为28.31亿美元。
2017年获批进口抗肿瘤新药还是以靶向药为主,其中肺癌产品2个,分别为阿法替尼片、奥希替尼片;白血病产品3个,分别为磷酸芦可替尼片、注射用阿扎胞苷、伊布替尼胶囊。上述产品中,2016年全球销售额超过10亿美元的重磅产品是伊布替尼和芦可替尼。预计2018年肺癌、白血病用药市场竞争将进一步加剧。
■糖尿病药
在糖尿病治疗领域,2017年批准上市的重磅产品有:达格列净片、利格列汀二甲双胍片、利格列汀片、恩格列净片、德谷胰岛素注射液、卡格列净片、利司那肽注射液。2016年上述产品全球销售额44.06亿美元。
品种:
达格列净片:2017年3月,阿斯利康公司达格列净片获批进口,商品名“安达唐”,规格为5mg、10mg。2016年达格列净全球销售额为9.07亿美元。
沙格列汀二甲双胍缓释片:2017年9月,勃林格殷格翰公司沙格列汀二甲双胍缓释片获批进口,商品名“欧双宁”,规格为2.5mg/500mg、2.5mg/850mg。2016年沙格列汀二甲双胍全球销售额为12.49亿美元。
利格列汀片:2017年9月,勃林格殷格翰利格列汀片获批进口,商品名“欧唐宁”,规格为5mg。2016年利格列汀全球销售额为16.85亿美元。
恩格列净片:2017年9月,勃林格殷格翰恩格列净片获批进口,商品名“欧唐静”,规格为10mg、25mg。2016年恩格列净全球销售额为2.02亿美元。
德谷胰岛素注射液:2017年9月,诺和诺德德谷胰岛素注射液获批进口,商品名“诺和达”,规格为3ml:300单位。2016年德谷胰岛素全球销售额为6.03亿美元。
卡格列净片:2017年9月,强生卡格列净片获批进口,商品名“怡可安”,规格为100mg、300mg。2016年卡格列净全球销售额为14.07亿美元。
利司那肽注射液:2017年9月,赛诺菲利司那肽注射液获批进口,商品名“怡可安”,规格为10μg剂量注射笔、20μg剂量注射笔。2016年利司那肽全球销售额为0.39亿美元。
在糖尿病治疗领域,2017年我国批准进口3个SGLT-2抑制剂药物,分别是达格列净、卡格列净、恩格列净;DPP-4抑制剂复合制剂有利格列汀二甲双胍片、沙格列汀二甲双胍缓释片;GLP-1胰高血糖素样肽受体激动剂有利司那肽注射液。这些新产品的上市,意味着新靶点DPP-4、GLP-1与SGLT-2糖尿病药物已快速引进中国。新靶点糖尿病药物涌入市场,必将搅动国内市场格局。
■丙肝药
在丙肝治疗领域,2017年批准上市的重磅产品有:阿舒瑞韦软胶囊、盐酸达拉他韦片、西美瑞韦胶囊、索磷布韦片、奥比帕利片、达塞布韦钠片。2016年上述产品全球销售额为72.07亿美元。
品种:
阿舒瑞韦软胶囊、达拉他韦片:2017年4月,百时美施贵宝阿舒瑞韦软胶囊、达拉他韦片获批进口,商品名分别为“速维普”和“百立泽”。2016年阿舒瑞韦和达拉他韦全球销售额合计为15.78亿美元。
西美瑞韦胶囊:2017年8月,强生西美瑞韦胶囊获批进口,商品名“奥莱森”,规格为150mg。2016年西美瑞韦全球销售额为1.06亿美元。
索磷布韦片:2017年9月,吉利德索磷布韦片获批进口,商品名“索华迪”,规格为400mg。2016年索磷布韦全球销售额为40.01亿美元,该药2014年全球销售额突破100亿美元。
奥比帕利片、达塞布韦钠片:2017年9月,艾伯维奥比帕利片、达塞布韦钠片获批进口,商品名分别为“维建乐”和“易奇瑞”,规格分别为12.5mg/75mg/50mg、250mg。2016年奥比帕利和达塞布韦合计全球销售额为15.22亿美元。
在丙肝治疗领域,2017年CFDA相继批准新型抗丙型肝炎药物阿舒瑞韦、达拉他韦、西美瑞韦、达塞布韦、奥比帕利、索磷布韦6个产品上市。目前,百时美施贵宝、强生、吉利德、艾伯维的口服丙肝新药已在国内上市。在美国丙肝市场经历了急速爆发和迅速萎缩后,已在欧美证实疗效显著的丙肝新药之战将在我国正式上演,这预示着国内丙型肝炎治疗领域市场将发生巨变。
■其他适应症
从其他适应症领域来看,2017年批准上市的重磅产品有:四价人乳头瘤病毒疫苗、注射用奥马珠单抗、沙库巴曲缬沙坦钠片、尼达尼布软胶囊。2016年上述4个产品全球销售额为32.49亿美元。
四价人乳头瘤病毒疫苗:2017年5月,默沙东公司宫颈癌疫苗四价人乳头瘤病毒疫苗获批进口,商品名“佳达修”,剂型为注射剂,规格为0.5mL。2009年四价人乳头瘤病毒疫苗全球销售额曾高达16.61亿美元。
注射用奥马珠单抗:2017年8月,诺华治疗慢阻肺的注射用奥马珠单抗获批进口,商品名“茁乐”,剂型为粉针剂,规格为150mg。2016年奥马珠单抗全球销售额为23.56亿美元。
沙库巴曲缬沙坦钠片:2017年9月,诺华治疗心衰新药沙库巴曲缬沙坦钠片获批进口,商品名“诺欣妥”,规格为50mg、100mg、200mg。2016年沙库巴曲缬沙坦全球销售额为1.7亿美元。
乙磺酸尼达尼布软胶囊:2017年9月,勃林格殷格翰公司治疗肺纤维化新药乙磺酸尼达尼布软胶囊获批进口,商品名“维加特”,规格为100mg、150mg。2016年尼达尼布全球销售额为7.23亿美元。
2017年,随着进口药注册政策的开放,对进口新药的倾斜力度加大,审评审批速度明显加快,进口新药大批量上市,已形成了新一波进口药浪潮。
(信息来源:医药经济报)Top
2017年7月31日,葛兰素史克(GSK)宣布,国内首个获批的宫颈癌疫苗希瑞适已正式上市,首批进口的希瑞适已经通过中国相关质检部门检验放行,供应全国市场。
而在随后不久的11月9日,默沙东四价HPV疫苗在中国大陆区域独家代理重庆智飞生物发布公告,称该疫苗目前已收到国家食品药品监督管理总局签发的《生物制品批签发合格证》,这也意味着默沙东既9月份四价HPV疫苗正式取得药品通关单以来,在中国市场迈出了更为实质性的一步。
十年等待,一朝爆发。2017年GSK与默沙东的宫颈癌疫苗相继获批,这一全球年销售额超10亿美元的重磅疫苗产品,在华又将有何新表现?
1.GSK对战默沙东
积蓄了十年的市场期待,GSK的二价疫苗希瑞适、默沙东的四价疫苗佳达修两款HPV疫苗在2017年相继上市,意味着在现阶段,宫颈癌防治这一潜力巨大的市场,需要GSK与默沙东两家企业在市场上直接较量。
先从定价来看。GSK方面透露,其统一中标价格为人民币580元/支。但接种者最终的付费价格则可能根据各地政策差异如是否执行零差价等,而略有不同。
至于默沙东方面,据了解,默沙东的四价HPV疫苗已经开始在各地参与招标,其中已经在云南、重庆、河南、江西、湖北、黑龙江等6个省份中标,价格均为798元/支,而其余省份的招标工作也在推进当中。
单从价格来看,默沙东的中标价格相对于7月份已经开始销售的GSK二价希瑞适580元的中标价格相比高了接近40%。不过,业内人士认为,两者之间不具有可比性,因为GSK产品适用范围是9周岁至25周岁,而默沙东产品的适用范围则是20周岁至45周岁,双方主要的竞争群体是在20周岁至25周岁。
当然,也有相关人士表示,默沙东的价格制定营销空间更大,此外相对高年龄人群的支付能力也较强。据统计目前中国适合四价HPV疫苗的人群为2.6亿,增量为900万,以默沙东的四价疫苗为例进行计算,考虑到目前中标价格798元/支,3针2400元,增量渗透率达30%,约合270万人,该产品规模达65亿元;若考虑存量市场渗透了达2%,则覆盖600万人,市场规模将超130亿元。
但二者的竞争绝非仅体现在价格之上,对于宫颈癌的防治能力更是一个重要的考核标准。作为严重威胁妇女健康的常见恶性肿瘤,我国目前每年宫颈癌新发病例为10万,死亡病例3万,是15岁至44岁女性中第三大高发癌症。这也是业界一直呼吁宫颈癌疫苗尽早上市的重要原因。
在此方面,GSK一直对其“预防保护效力”着重宣传。来自GSK的资料显示,在一项长达4年、入组超过18000人的全球大规模临床研究中,希瑞适对未感染人群中由HPV16、18引起的宫颈癌前病变(CIN3+)的预防保护效力达到100%。同时,因其对其它致癌型HPV的良好交叉保护效果,希瑞适对所有型别HPV所引发的宫颈癌前病变(CIN3+)的总体保护效力达到了93.2%。
而默沙东四价疫苗所具备的优势,则主要体现在两方面,一是年龄,其适用范围更广;其次则是价数更高,相较于GSK的二价疫苗来说适应症更多,其是全球第一个,也是唯一获准上市用于预防由HPV6、11、16和18型引起的宫颈癌和生殖器官癌前病变的癌症疫苗,但集中在宫颈癌预防方面,两者起作用的价数相同。
同样值得注意的是,GSK产品先行上市,实际上也为默沙东四价HPV疫苗上市缩短了市场导入期,使得默沙东上市之后就能迅速展开销售。而在营销层面,默沙东依靠智飞生物做国内市场的独家代理也是一大利器。
2.开战在即
漫长等待之后,超出人们预期的是四价HPV疫苗获得批签发的迅速。
以默沙东的四价HPV疫苗为例,从时间来看,2017年5月22日,佳达修正式获得国家食品药品监督管理总局颁发的药品注册批件,2017年9月18日,第一批疫苗取得了北京市食品药品监督管理局签发的《进口药品通关单》,之后送中检院批签发。一般按照《生物制品批签发管理办法》规定,中检院批签发将在60个工作日左右完成,而此次默沙东的四价HPV疫苗花费不足2个月时间,已经超出了市场预期。
而获批之后,不管是GSK还是默沙东,都已马不停蹄的开展了各地的招标活动。根据公开信息,默沙东的四价HPV疫苗已在河南、云南、重庆、黑龙江、江西、湖北等六个省(直辖市)中标,而其他省份也已按各省招投标进展提交或准备提交相关招投标资料。
GSK方面曾表示,截至2017年8月份,全国已经有包括重庆、贵州、陕西、云南等在内的17个省、直辖市开放了疫苗招标窗口,而过去一年时间中GSK则完成了希瑞适在上述17个省份的招标准入工作。
获批之后,先申请中标,再推动上市销售,这是疫苗领域的普遍操作流程,因此在各省完成招标准入之后,接下来便是等待各地根据实际接种情况发出具体的订单。“我们根据各地方区县疾控单位的订单正在积极发货。同时在尚未招标的地区,我们也在积极申请补标工作,以满足广大女性的接种需求。”GSK方面表示,目前已经处于全力备产状态,以确保宫颈癌疫苗在各地的供应。
而随着两家产品的陆续上市,GSK与默沙东的战役已经正式打响。但在其后,一大批国产企业同样跃跃欲试,国内HPV疫苗研发及产业化的竞争已堪称激烈。
据统计,目前我国已经有11家药企递交了HPV疫苗的临床申请,其中四价疫苗3家,六价疫苗1家,九价疫苗4家,其中默沙东的九价疫苗也在评审中。
“药物临床试验登记与信息公示平台”显示,目前包括成都所、北京所、上海泽润、厦门万泰沧海、上海博唯生物等多家公司在内都已有HPV疫苗相关试验正在进行之中,沃森生物的子公司上海泽润,目前其已经开始了三期临床并持续开展妇科随访收集病历以及临床样本检测的工作,其研发的九价HPV疫苗临床研究申请也已获得受理。厦门大学与厦门养生堂生物技术公司合作进行的二价HPV疫苗三期临床试验也正在进行之中。
只是,目前的情况对本土药企而言颇具压力,因为根据市场预估,最快的沃森旗下上海泽润的HPV疫苗最快也得2019年才上市,届时,GSK与默沙东已经占据市场高点,想要在未来与其竞争,打价格战是无法避免的事。
(信息来源:E药经理人)Top
上海医药收购康德乐中国后,就有行业研究人士向赛柏蓝表示,上海医药和国控在两广地区的“争夺战”一触即发。
而在上药收购康德乐的背后,在医药流通巨头争夺的背后是上千亿不容忽视的处方外流市场。
目前,国内DTP药房规模仍处于起步阶段,2015年销售规模约80亿元,2016年已超过百亿元。
平安证券预测,医药零售渠道在2017年能够享有的处方流出增量超过900亿元,2020年市场空间约6100亿元,预计处方药将主要流向DTP药房及院边店,DTP药房市场占有率将高达54%。
■政策多重利好,DTP药房兴起
2018年2月2日,上海医药公告称,全资子公司Century Global以现金5.76亿美元收购康德乐马来西亚并完成交割,进而通过康德乐马来西亚间接拥有其于中国香港及内地设立的全部中国业务实体(康德乐中国)。
公开资料显示,康德乐中国拥有14个当地直销公司,覆盖全国13个重点城市,次级网络覆盖322座城市,服务近11000家医疗机构,同时拥有30家DTP药房。
众所周知,康德乐中国的竞争优势主要集中在DTP药房上。据悉,康德乐中国30家DTP药房目前年销售额可达6亿元至7亿元,单店销售额一般能达2000万元,是普通零售药店单店销售的40倍,每年服务患者数约15万至20万人次。
DTP药房模式,即药店获得制药企业产品经销权,患者在医院获得处方后从药店直接购买药品并获得专业指导与服务的模式。区别于以出售OTC药品为主的传统零售药店,DTP药房主要销售高毛利专业药物、新特药、自费药等药品,是零售药店的进阶模式。
2017年是医改大年,多方政策利好DTP业务的发展。公立医院改革政策推进医药分家趋势的进一步落实;各地集采招标与医保谈判品种推动药品降价,倒逼高值药品流向零售终端;药审制度的改革,加速新药的研发,也提升仿制药的质量。根据2017年新版医保目录,更多独家新药产品、重大创新药纳入医保目录,极大改善DTP药房普通消费者支付能力欠缺的问题。
在国外,处方药配送渠道的改变也是由于医疗政策的改变,医药分开的发展,以及减少中间商环节降低成本等。
其实,国外并没有所谓的DTP/DTC药房。DTP/DTC只是一种处方药品的提供配送渠道改变,一种上游厂商的药品配送策略改变。为了应对政策趋势与降低中间商环节,越来越多的处方药工业厂商采取了DTP/DTC的配送策略改变,转向直接与药房合作,,透过药房直接提供与配送药品给病患。
药房也积极寻求与工业厂商合作的机会,以争取厂商的进货渠道支持,以能满足大量由医院释放出的慢性病处方调配需求。
在中国,DTP药房正吸引着越来越多的上市公司。目前,除了上海医药通过收购康德乐马来西亚加码DTP药房外,已有国药一致、华润医药等一批大型医药流通上市公司,凭借其品种及价格优势布局DTP药房。
此外,益丰药房、老百姓、一心堂等上市民营连锁药房也希望借助其连锁化特征,在DTP业务领域能够享有终端市场的品牌效应及地理优势。
■药企抢占千亿处方外流市场
DTP药房为医药工业提供医药分家后的药品销售渠道和稀缺的一手患者用药信息。DTP药房容纳了医院流出的大量处方药购买需求,承担了部分慢病管理职能,并可以通过职业药师为患者提供个性化用药意见和专业的物流配送服务。
DTP药房的出现,在药品零售模式上,将会带来新改变:
一是实现医药分流,有助于解决看病难、看病贵的问题;
二是联合医院、工业企业,对患者提供专业服务,能更好地指导患者合理用药;
三是作为医药工业,缩短了流通中间环节,降低了患者的用药成本。
目前,国内DTP药房规模仍处于起步阶段,2015年销售规模约80亿元,2016年已超过百亿元。平安证券预测,医药零售渠道在2017年能够享有的处方流出增量超过900亿元,2020年市场空间约6100亿元,预计处方药将主要流向DTP药房及院边店,DTP药房市场占有率将高达54%。
目前,国内的DTP药房主要分为三类:
第一类是上药、国药、华润这类商业公司开设的DTP药房,商业公司与工业合作紧密,在渠道上和价格政策上有比较明显优势,例如北京医保全新、国大药房、上海众协药店、康德乐大药房等;
第二类是连锁药房开设,老百姓、一心堂、京卫大药房;
第三类是电商企业开的,本质也是连锁药房,如健客网启动线下药房布局后也宣布了开始建设DTP药房。
上海医药、国药一致、华润医药等一批大型医药流通上市公司凭借其品种及价格优势,积极布局DTP药房。
上海医药在华东、华北地区已拥有40余家DTP药房,加上此次收购的康德乐中国的30家DTP药房,公司将拥有国内最大的DTP业务。DTP药房不仅能利用公司自有的“大健康云商”平台,尝试打包全国门店收集的患者数据,向企业提供有效用药信息,还可凭借公司搭建的专业冷链物流团队,保证处方药配送的安全性。
国药一致旗下的国大药房2014年正式进军DTP药房领域。2016年,国大药房DTP业务突破10亿元,业务占比10%以上,门店数量16家。公司持续在DTP业务上进行探索,建立现代化、标准化信息数据管理系统,搭建电子处方登记系统及全国DTP数据库,充分利用一手病患数据拓展第三方咨询服务业务。
益丰药房、老百姓、一心堂等上市民营连锁药房也在尝试借助其连锁化特征,在DTP业务领域有所斩获。一心堂在2015年专门成立处方药事业部,发展DTP品种,承接处方药外流业务,并在2016年宣布进军DTP药房领域。老百姓采取直接并购门店、收购少数股权、收购公司及门店等多种并购拓展策略跨区域整合,涉及并购金额超过15亿。
可见,DTP模式将是众多药企争夺千亿处方外流市场的重要落点。
(信息来源:上海证券报等)Top
CFDA药品审评中心发布的《拟纳入优先审评程序药品注册申请的公示(第二十六批)》,将39个拟优先审评的药品注册申请及其申请人予以公示。据公示名单,此次入选的39个药品中,16个药品为仿制药上市,9个药品为新药临床,10个为新药上市,4个为增加新适应症。
亮点一:三款CAR-T细胞药物入选
在第二十六批优先审评名单中,入选的三款CAR-T细胞药物是:上海恒润达生、科济生物和银河生物的3个CAR-T疗法的临床申请。纳入理由是:使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请。
紧跟国际步伐
细胞治疗技术是目前国际医学前沿重点发展的领域,它给一些人类疑难疾病的治疗提供了新希望。近年来,细胞治疗领域不断取得新的研究成果,细胞治疗产品的研发与评价也日益受到国内外制药企业及各国政府的高度关注。2017年12月22日,CFDA发布《细胞治疗产品研究与评价技术指导原则(试行)》,整个细胞治疗领域将迎来规范化发展,发展速度也将大大提升,国内CAR-T细胞药物申报快速跟进国外研发速度,市场前景值得期待。
国内细胞治疗研发紧跟美国步伐,目前已有6家公司的临床申请获得受理,除此次纳入优先审评公示名单的3家公司之外,还有:2017年12月18日南京传奇生物的CAR-T细胞自体回输制剂被纳入第25批优先审评名单;2018年1月8日博生吉安科细胞技术公司的CD19T细胞注射剂;2018年1月12日上海名聚生物的JWCAR029已进行申报。
获批在望
目前,全球共有两个CAR-T产品获批上市,分别是诺华的Kymriah(tisagenlecleucel)和Kite制药的Yescarta(KTE-C19)。Kymriah获批用于治疗儿童和年轻成人(2~25岁)的急性淋巴细胞白血病(ALL),年费用47.5万美元;Yescarta获批用于治疗特定类型大B细胞淋巴瘤,年费用37.3万美元。有专家预测,我国首个自主研发的CAR-T疗法药物有望在3年内获批,而年费用也会降到人们可承受的范围内,甚至是10万元以内。
亮点二:国产首个生物类似药上市冲刺
复星医药利妥昔单抗注射液上市申请被纳入优先审评公示名单,意味着首个国产生物类似药上市进入最后冲刺阶段。
连续四年全球销售过70亿
利妥昔单抗由罗氏旗下基因泰克开发,1997年11月获准在美国上市,商品名为“Rituxan”。1998年6月2日获得欧洲EMA批准;2001年6月20日获得日本PMDA批准;2008年4月21日获CFDA批准上市,并由百健和罗氏在美国、欧洲、日本和中国市场销售。该产品主要用于非霍奇金淋巴瘤和淋巴细胞白血病的治疗,为全球首个获批的CD20类单抗。该药是罗氏公司的主打品种,印度、俄罗斯和拉丁美洲几个国家市场已经有几种仿制产品。
据全球畅销药数据统计,2016年利妥昔单抗销售额为74.1亿美元,同比增长1%。2005-2016年该产品年复合增长率为7.5%。2007年该药全球销售额突破50亿美元,2013-2016年连续4年全球销售额突破70亿美元。该药欧盟专利在2015年失效,并将于2018年在美国专利期满。
国内销售增势猛
据样本医院数据统计,利妥昔单抗2016年用药金额为9.8亿元,较同期增长23.5%,2005-2016年年复合增长率为28.1%。该产品自2012年起样本医院用药金额过5亿元,在国内样本医院抗体药物领域销售额排名第一。在国内市场刚性需求拉动下,继续表现出强劲的增长态势。
利妥昔单抗由罗氏于2000年获批在国内上市,商品名为“美罗华”,剂型为注射液,规格有500mg:50ml和100mg:10ml两种。该产品是非霍奇金氏淋巴瘤的“金标准”治疗药物,并作为晚期结肠癌的一线用药。
首仿产品预计年内获批
目前国内正在申报利妥昔单抗的企业有复宏汉霖、正大天晴、华兰基因、神州细胞、信达生物、浙江海正等。利妥昔单抗是复星医药第一个大分子单抗药物,也是国内首个生物类似药。复星医药的子公司复宏汉霖利妥昔生物类似药累计研发投入超过3亿元,预计将在2018年内获批。据专业人士预测,该产品上市后市场潜力巨大,年销售额有望超过30亿元。目前复星医药大分子单抗药物布局齐全,类似药系列处于国内前列,后续产品梯队较为丰富。
亮点三:豪森坐拥三个重磅品种
江苏豪森的重磅药物聚乙二醇洛塞那肽、阿哌沙班、维格列汀均在此次公布的优先审评名单中。未来几年,这几个重磅药物将给豪森带来新一轮飞跃。
国产原创长效GLP-1重磅
聚乙二醇洛塞那肽是由江苏豪森自主研发的1类化药,属于长效GLP-1受体激动剂,拟用于单药或与二甲双胍联合治疗2型糖尿病,该产品每周只需注射1次。
2007年3月,豪森初次申报洛塞那肽化药1.1类的临床研究;2008年10月获得临床批件;2015年1月、7月完成两项重要的Ⅲ期临床试验;2017年10月开始注册受理;2017年12月6日进入审评中心;2018年1月报产获优先审评。与此同时,洛塞那肽2008年入选国家“863计划”,2010、2012年两次获得国家科技重大专项支持等。江苏豪森该品种从初次申报临床到报产获优先审评已经走过了近11个年头。
截至目前,全球共有7个GLP-1受体激动剂类药物上市,其中,阿必鲁肽、度拉糖肽、索马鲁肽以及注射用艾塞那肽微球均为每周注射1次的长效GLP-1受体激动剂。值得一提的是,2018年1月4日,三生制药的GLP-1受体激动剂注射用艾塞那肽微球获得CFDA批准上市,用于2型糖尿病的治疗。由此,三生制药的注射用艾塞那肽微球成为国内首个获批上市的长效GLP-1受体激动剂。然而该药并不是三生制药自主研发的,2016年三生制药与阿斯利康达成战略合作,三生制药拥有Byetta/百泌达和Bydureon/百达扬的中国独家商业权。而江苏豪森的洛塞那肽是国产长效GLP-1受体激动剂,业内人士估计该药最早将于2018年第三季度获批。
阿哌沙班争抢仿
阿哌沙班由百时美施贵宝开发,2013年1月获准在中国注册,商品名为“艾乐妥”,主要用于髋关节或膝关节择期置换术的成年患者预防静脉血栓栓塞症。剂型为片剂,规格为2.5mg。2016年阿哌沙班全球销售额为33.43亿美元,较2015年增长80%,销售额几乎翻番,增长迅猛。
据国内样本医院数据统计,国内阿哌沙班市场规模从2013年的116万元增长到2015年的510万元,2016年与2015年基本持平。2017年,阿哌沙班进入国家新版医保目录,2017年1-3季度该药销售额已达534万元。
经检索CFDA数据库,目前国内申报阿哌沙班制剂的企业有近30家,主要企业有江苏豪森药业、南京润诺生物科技、正大天晴药业、齐鲁制药(海南)、广东东阳光药业、山东新时代药业等。百时美施贵宝的阿哌沙班在国内申请的化合物专利2022年到期。据了解,此化合物正在走无效程序。一旦专利被无效掉,豪森的的首仿品种将第一时间进入市场,并给其带来不错的业绩。
维格列汀DPP-4首仿
维格列汀由诺华制药研发。2007年9月28日,维格列汀获得欧盟批准,商品名为“Galvus”,首先在欧盟国家及挪威和爱尔兰上市。据全球畅销药数据统计,2012-2016年该药销售额分别为9.10亿美元、12.00亿美元、12.24亿美元、11.85亿美元、11.93亿美元。该产品已连续五年销售额超过10亿美元。
2011年8月,诺华的维格列汀片获准进入我国,商品名为“佳维乐”。目前国内已上市多种DPP-4抑制剂,主要有西格列汀、利格列汀、维格列汀、沙格列汀和阿格列汀,均为进口原研,国内无仿制上市。维格列汀2019年专利到期,豪森药业维格列汀成功进入仿制药上市优先审批。不出意外的话,豪森糖尿病又一重磅品种维格列汀将成为首仿产品。
2016年,国内样本医院单方制剂DPP-4抑制剂销售额为1.83亿元。其中,西格列汀为8246万元、沙格列汀5226万元、维格列汀3042万元、利格列汀1260万元、阿格列汀561万元。
目前豪森的糖尿病产品线主要有3款产品:瑞格列奈二甲双胍片、瑞格列奈片、格列齐特缓释片。在主要产品中,瑞格列奈片是内分泌线重要品种,豪森瑞格列奈2016年样本医院销售额为4972万元,是豪森内分泌产品线销售额主要贡献者。维格列汀如能首仿获批,将为豪森糖尿病产品线再添一个重磅产品。
(信息来源:医药经济报)Top
| 



